
科目: 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由C(石墨)→C(金刚石);△H=+1.9kJmol-1可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3KJ
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A. 4 mo1SO2和2mol O2
B. 4mol SO2、2mo1 O2和2mol SO3
C. 4mol SO2.和4 mo1 O2
D. 6mo1 SO2和4 mo1 O2
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温条件下,体积固定的密闭容器中,进行可逆反应A(s)+3B(g)![]() 3C(g),下列不能说明可逆反应达到平衡状态的是
3C(g),下列不能说明可逆反应达到平衡状态的是
A. B的浓度不再变化
B. 混合气体的压强不再变化
C. 混合气体的密度不再变化
D. 混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目: 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是

A. A处通入空气,B处通入水煤气
B. a电极的反应式包括:CO+4OH--2e-= CO32-+2H2O
C. a电极发生还原反应,b电极发生氧化反应
D. 如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气4.48 L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在水溶液中一定能大量共存的是( )
A. 含有大量 Ba2+的溶液中:Cl- K+ ![]()
![]()
B. 含有大量H+的溶液中:Mg2+ Na+ ![]()
![]()
C. 含有大量OH-的溶液中:Mg2+ ![]()
![]()
![]()
D. 含有大量Na+的溶液中:H+ K+ ![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在生产生活中有广泛应用。
(1)![]() 可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向
可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向![]() 的铁屑中通入
的铁屑中通入![]() 生产无水
生产无水![]() 。已知:
。已知:![]() 固体呈黑棕色、易潮解、
固体呈黑棕色、易潮解、![]() 左右时升华。
左右时升华。
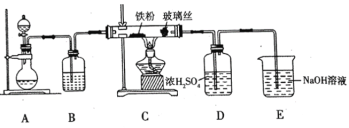
回答下列问题
①写出用高锰酸钾和浓盐酸在装置![]() 中制备氯气的离子方程式_____。
中制备氯气的离子方程式_____。
②装置![]() 中加入的试剂是_____,装置
中加入的试剂是_____,装置![]() 中玻璃丝的作用是_____,
中玻璃丝的作用是_____,![]() 中
中![]() 溶液的作用是_____。
溶液的作用是_____。
③有同学认为气体通入装置![]() 前应除去其中含有的
前应除去其中含有的![]() ,改进措施为_____。
,改进措施为_____。
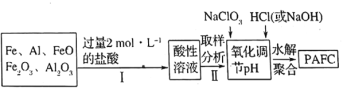
(2)一种新型高效净水剂![]() (聚合氯化铁铝
(聚合氯化铁铝![]() ,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取
,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取![]() ,设计生产流程如下:
,设计生产流程如下:
①实验室现需用![]() 的稀盐酸,欲用
的稀盐酸,欲用![]() 的浓盐酸配制,则所需浓盐酸体积为________。
的浓盐酸配制,则所需浓盐酸体积为________。
②![]() 中
中![]() 显________价,
显________价,![]() 在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
③步骤Ⅱ中取样分析的目的是________。
A.测定溶液中![]() 与
与![]() 的含量比 B.测定原料是否完全溶解
的含量比 B.测定原料是否完全溶解
C.测定溶液中![]() 的含量,以确定加入
的含量,以确定加入![]() 的量 D.测定溶液中
的量 D.测定溶液中![]() 的含量
的含量
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化镓![]() 为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
(1)基态![]() 原子核外电子占据最高能级的电子云轮廓图为________形。
原子核外电子占据最高能级的电子云轮廓图为________形。
(2)砷化镓可由![]() 和
和![]() 制得。在常温常压下,
制得。在常温常压下,![]() 为无色透明液体,则
为无色透明液体,则![]() 固体属于________晶体。
固体属于________晶体。![]() 的沸点低于
的沸点低于![]() 的原因为________。
的原因为________。
(3)亚砷酸![]() 是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测
是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测![]() 的空间构型为________;与
的空间构型为________;与![]() 互为等电子体的一种分子为________。
互为等电子体的一种分子为________。
(4)![]() 的熔点为
的熔点为![]() ,晶胞结构如图所示:
,晶胞结构如图所示:
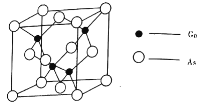
①在![]() 晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
②若砷化镓晶胞边长为![]() 。则该晶体密度为________
。则该晶体密度为________![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,烧杯中的溶液为2 mol·L-1CH3COOH溶液,接通直流电源。分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
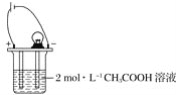
A.加入固体NaOHB.加水稀释C.加入金属NaD.通入HCl气体
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种新型的汽车动力燃料。回答下列问题:
⑴工业上可通过![]() 和
和![]() 化合来制备甲醇。已知某些化学键的键能数据如下表:
化合来制备甲醇。已知某些化学键的键能数据如下表:
化学键 |
|
|
|
|
|
键能 | 413 | 436 | 358 | 1072 | 463 |
已知![]() 中的
中的![]() 与
与![]() 之间为三键,则工业制备甲醇的热化学方程式为________。
之间为三键,则工业制备甲醇的热化学方程式为________。
⑵某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为![]() 的密闭容器内充入
的密闭容器内充入![]() 和
和![]() ,加入合适催化剂(体积可以忽略不计),在
,加入合适催化剂(体积可以忽略不计),在![]() 时开始反应,并用压力计监测容器内压强的变化如下表:
时开始反应,并用压力计监测容器内压强的变化如下表:
反应时间/ | 0 | 5 | 10 | 15 | 20 | 25 |
压强/ | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到![]() 时,以
时,以![]() 表示的平均反应速率
表示的平均反应速率![]() ________,该温度下平衡常数
________,该温度下平衡常数![]() ________
________![]() ,若升高温度,则
,若升高温度,则![]() 值________(填“增大”“减小”或“不变")。
值________(填“增大”“减小”或“不变")。
⑶模拟工业合成甲醇的反应,下图是4种投料比![]() 分别为
分别为![]() 、
、![]() 、
、![]() 、
、![]() 下,反应温度对
下,反应温度对![]() 平衡转化率影响的曲线。
平衡转化率影响的曲线。
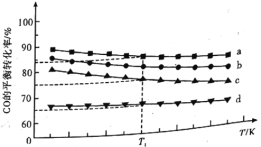
①曲线![]() 对应的投料比为________。
对应的投料比为________。
②当曲线![]() 、
、![]() 、
、![]() 对应的投料比达到相同的
对应的投料比达到相同的![]() 平衡转化率时,对应的反应温度与投料比的关系是________。
平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为![]() 、反应温度为
、反应温度为![]() 时,平衡混合气中
时,平衡混合气中![]() 的物质的量分数是________(精确到
的物质的量分数是________(精确到![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com