
科目: 来源: 题型:
【题目】乙烷和丙烷的混合气体完全燃烧后,先将产物通过浓硫酸,浓硫酸增重30.6 g ,然后通过碱石灰,碱石灰增重52.8 g,混合气体中乙烷和丙烷的体积比为( )
A.1∶1
B.2∶3
C.3∶2
D.3∶5
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时间内生成n mo1 O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】亚铁氰化钠晶体[Na4Fe(CN)6·10H2O,M=484g·mol-1]可用作食盐抗结剂。请回答
(1)向Na4Fe(CN)6溶液中滴入FeCl3溶液,出现蓝色沉淀,其离子方程式为______________。
(2)已知:Ag4Fe(CN)6为白色难溶物, Cu2Fe(CN)6为红棕色难溶物。市售亚铁氰化钠常含有Cl-杂质,选用下列试剂设计实验方案进行Cl-检验。
试剂:稀HNO3、稀H2SO4、AgNO3溶液、CuSO4溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③_______ | ④______ |
⑤静置,_____ | ⑥出现白色浑浊 |
(3)利用铈量法测定亚铁氰化钠晶体纯度的实验如下:称取1.2100g样品,置于500mL仪器a中,加入25mL除氧蒸馏水,加入25mL浓硫酸酸化并冷却,滴加3滴橘红色邻二氮菲(phen)—FeSO4指示剂,用0.1000mo1·L-1的Ce(SO4)2标准溶液滴定,发生反应:Ce4++[Fe(CN)6]4-=Ce3++[Fe(CN)6]3-。当溶液从橘红色变为淡黄色,即为终点。平行滴定3次,标准溶液的平均用量为24.50mL。
①仪器a的名称为_________________。
②“浓硫酸酸化”的实验操作为______________________
③样品纯度为__________________%
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
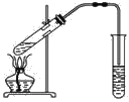
(1)写出左试管中主要反应的化学方程式:_________________________________。
(2)加入浓硫酸的作用:_________________。
(3)反应开始时用酒精灯对左试管小火加热的原因是____________________________(已知乙酸乙酯的沸点为77 ℃;乙醇的沸点为78.5 ℃;乙酸的沸点为117.9 ℃);后改用大火加热的目的是______。
(4)分离右试管中所得乙酸乙酯和饱和Na2CO3溶液的操作为________(只填名称),所需主要仪器为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。请回答:
(1)如图表示在CuO存在下HCl催化氧化的反应过程,则总反应的化学方程为______。

(2)研究HCl催化氧化反应中温度、![]() 和
和![]() 等因素对HCl转化率的影响,得到如下实验结果:
等因素对HCl转化率的影响,得到如下实验结果:
①利用Na2S2O3溶液和KI溶液测定反应生成Cl2的物质的量,若消耗V1mLc1mol·L-1的Na2S2O3溶液,则生成Cl2____________mol(已知2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)。
+2I-)。
②![]() 表示催化剂的质量与HCl(g)流速之比,是衡量反应气体与催化剂接触情况的物理量。当
表示催化剂的质量与HCl(g)流速之比,是衡量反应气体与催化剂接触情况的物理量。当![]() =4、
=4、![]() =50g·min·mol-1时,每分钟流经1g催化剂的气体体积为_____L(折算为标准状况下)。
=50g·min·mol-1时,每分钟流经1g催化剂的气体体积为_____L(折算为标准状况下)。
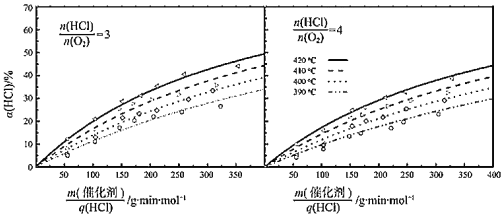
③在420℃、![]() =3、
=3、![]() =200g·min·mol-1条件下,α(HCl)为33.3%,则O2的反应速率为_______mol·g-1·min-1。
=200g·min·mol-1条件下,α(HCl)为33.3%,则O2的反应速率为_______mol·g-1·min-1。
④比较在下列两种反应条件下O2的反应速率:vⅠ_______vⅡ(填“>”“=”或“<”)。
Ⅰ.410℃、![]() =3、
=3、![]() =350g·min·mol-1;
=350g·min·mol-1;
Ⅱ.390℃、![]() =4、
=4、![]() =350g·min·mol-1。
=350g·min·mol-1。
(3)在101.325kPa时,以含N2的HCl和O2的混合气体测定不同温度下HCl催化氧化反应中HCl的平衡转化率,得到如图结果
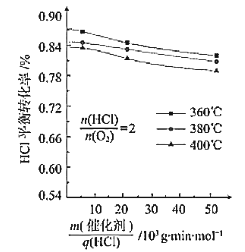
①360℃时反应的平衡常数K360与400℃时反应的平衡常数K400之间的关系是K360_________K400。(填“>”“=”或“<”)。
②一定温度下随着![]() 的增大,HCl的平衡转化率_______(填“增大”“减小”或“不变”),原因为___________________。
的增大,HCl的平衡转化率_______(填“增大”“减小”或“不变”),原因为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中________区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式___________。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为_________________。
②溶液中的水存在H3O+、![]() 等微粒形式,
等微粒形式,![]() 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则![]() 的结构式为___________。
的结构式为___________。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:
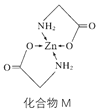
①1 mol M含有的σ键的数目为___________。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、![]() 等,NH3的分子空间构型为____________,
等,NH3的分子空间构型为____________,![]() 的中心氮原子杂化方式为__________。
的中心氮原子杂化方式为__________。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷__________(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ ZnX2 | ZnF2 | ZnCl2 | ZnBr2 |
熔点/℃ | 872 | 283 | 394 |
则ZnX2熔点如表变化的原因是____________________。
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加德罗常数的值。则该晶体的密度为________g·cm-3(写计算表达式)。
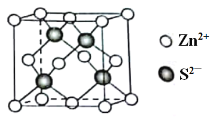
查看答案和解析>>
科目: 来源: 题型:
【题目】已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)=2NH3(g) ΔH=-92.0 kJ/mol,将1 mol N2和3 mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时向该容器中充入2 mol NH3,反应达到平衡时的热量变化是( )
A.吸收18.4 kJ热量B.吸收73.6 kJ热量
C.放出18.4 kJ热量D.放出73.6 kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】①用50mL 0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称__,另一处错误是____。
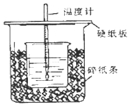
②实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应该选择___molL-1的溶液进行实验。大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)。
③如果用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会____;(填“偏大、偏小、无影响”)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L的NaOH溶液所求中和热____(填“相等、不相等”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com