
科目: 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
B | 加热乙醇与浓硫酸的混合溶液,将产生的气体通入少量酸性KMnO4溶液,溶液紫红色褪去 | 有乙烯生成 |
C | 向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,充分反应后,萃取分液,向水层中滴加KSCN溶液,溶液呈血红色 | I-与Fe3+的反应有一定限度 |
D | 向NaHCO3溶液中滴加紫色石蕊试液,溶液变蓝 | Kw<Ka1(H2CO3)×Ka2(H2CO3) |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g)。经2min后测知D的浓度为0.5molL-1,A与B的物质的量之比为3:5,C的平均反应速率是0.125molL-1min-1,求
(1)x值_______________;
(2)2min后A的物质的量浓度_______________;
(3)B的转化率_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解含ClO2的NaCl溶液可以获得消毒剂NaClO2,该工艺尾气吸收时的反应为2ClO2 + 2NaOH + H2O2 = 2NaClO2 + O2 + 2H2O。下列有关说法正确的是

A.电解时,化学能会转化为电能和热能
B.电解时,ClO2转化为ClO的反应发生在阳极
C.尾气吸收生成11.2 L O2时,H2O2失去1 mol电子
D.2H2O2(aq)=2H2O(l) + O2(g) ΔH<0过程中的能量变化如图所示
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述正确的是
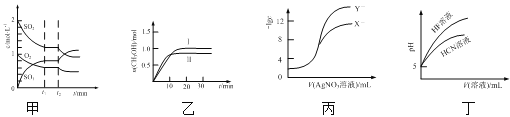
A.图甲表示一定条件下反应2SO2(g) + O2(g)![]() 2SO3(g)中各物质的物质的量浓度随时间的变化,说明t2时刻仅缩小了容器的容积
2SO3(g)中各物质的物质的量浓度随时间的变化,说明t2时刻仅缩小了容器的容积
B.图乙表示反应CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH<0在恒容密闭容器中,其他条件相同时,仅改变反应温度,n(CH3OH)随时间的变化,说明KⅠ>KⅡ
CH3OH(g) + H2O(g) ΔH<0在恒容密闭容器中,其他条件相同时,仅改变反应温度,n(CH3OH)随时间的变化,说明KⅠ>KⅡ
C.图丙表示用0.01 mol·L1 AgNO3溶液滴定浓度均为0.01 mol·L1的NaX、NaY混合溶液时,-lgc随AgNO3溶液体积的变化,说明Ksp(AgY) >Ksp(AgX)
D.图丁表示25℃时,加水稀释10 mL pH均为5的HF与HCN溶液时,溶液的pH随溶液体积的变化,说明Ka(HCN) >Ka(HF)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaClO溶液中通入过量CO2:ClO-+ CO2 + H2O = HClO + HCO![]()
B.向FeCl3溶液中加入铜粉:Fe3+ + Cu = Fe2+ + Cu2+
C.用NaOH溶液吸收NO2:2OH-+ 2NO2 = 2NO![]() + H2O
+ H2O
D.向AlCl3溶液中滴加氨水:Al3+ + 3OH-=Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】以白云石(主要成分为CaCO3和MgCO3)为原料制备氧化镁和轻质碳酸钙的一种工艺流程如下:
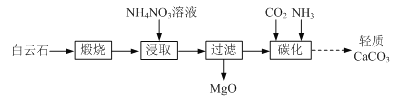
已知:Ksp[Mg(OH)2] = 5×1012
(1)白云石高温煅烧所得固体产物的主要成分为_______(填化学式)。
(2)NH4NO3溶液呈酸性的原因为_______(用离子方程式表示)。
(3)“浸取”后,c(Mg2+)应小于5×106 mol·L1,则需控制溶液pH ______。
(4)“碳化”反应的化学方程式为_______。
(5)煅烧所得固体的活性与其中CaO含量及固体疏松程度有关。其他条件相同时,将不同温度下的煅烧所得固体样品加入酸化的酚酞溶液中,引起溶液变色所需时间不同,由此可知煅烧所得固体的活性差异。溶液变色的时间与各样品煅烧温度的关系如图所示。当温度高于950 ℃时,煅烧所得固体易板结,活性降低;当温度低于950 ℃时,活性降低的原因为_______。将不同温度下的煅烧所得固体样品加入水中,也可测量其活性,则此时需测量的数据为相同时间后_______与样品煅烧温度之间的关系。

查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氯气的装置如图所示:

(1)实验原理:______________。
(2)实验装置:气体制备型化学实验装置的设计,要将化学反应原理、气体净化、收集和尾气处理等结合起来。
①填写装置中试剂名称,C______________,D____________,F__________。
②其中C的作用是除去氯气中的____________;D的作用是除去氯气中的____________。
③该装置中收集氯气使用的是________,还可用排__________的方法,原因是_____________。
④其中F的作用是_____________。
⑤检验氯气是否收集满可用__________放在集气瓶口,若试纸______,则证明已集满。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:

已知:①![]() ;②
;②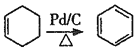 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R五种短周期非金属元素原子序数依次增大,X、Y、Z、W为同周期元素且未成对电子数之比为1:2:3:2,R和Z同主族。请回答下列问题:
(1)Z的基态原子的价层电子排布图为___。
(2)Z、W、R三种元素的电负性由大到小的顺序为___(用元素符号表示)。
(3)W的常见氢化物氧键的键能小于HF氢键的键能,但W的常见氢化物常温下为液态而HF常温下为气态的原因是___。
(4)某种分子式为Y4Z4W8的物质(该物质中同种原子的化学环境完全相同,不含碳碳双键)是一种威力极强的炸药,则可推知其结构简式为___。
(5)XR是一种耐磨材料,可由X的三溴化物和R的三溴化物于高温下在氢气的氛围中合成。
①X的三溴化物分子中X原子的杂化方式为___,R的三溴化物分子的空间构型的名称为___。
②合成XR的化学方程式为___。
(6)Y与W形成的某种常见化合物的晶胞如图,该晶体中分子的配位数为___,若晶胞的棱长为anm,阿伏加德罗常数的值为NA,晶体的密度为___g/cm3。

查看答案和解析>>
科目: 来源: 题型:
【题目】H2S是一种剧毒气体,工业生产中可以通过多种手段对其进行回收或再利用。
Ⅰ.900℃时可以用克劳斯法回收H2S气体,该过程中涉及的部分反应如下:
①2H2S(g)+O2(g)![]() S2(g)+2H2O(g) △H=-316.8kJmol-1
S2(g)+2H2O(g) △H=-316.8kJmol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=-1040.2kJmol-1
(1)4H2S(g)+2SO2(g)![]() 3S2(g)+4H2O(g)的△H=___
3S2(g)+4H2O(g)的△H=___
(2)若在900℃以上绝热、恒容的密闭容器中,投入一定量的H2S、O2发生反应①,下列说法能说明反应达到平衡状态的是___
a.混合气体密度不随时间变化而变化
b.v正(O2)=2v逆(H2O)
c.体系压强不随时间变化而变化
d.反应体系温度不变
e.混合气体平均相对分子质量不变
f.单位时间内生成nmolS2,同时生成2nmolH2S
Ⅱ.工业上还可以通过硫化氢分解对其进行处理、利用:2H2S(g)![]() S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图1所示:
S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图1所示:

(3)950℃时,0~1.25s生成S2(g)的平均反应速率为___
(4)该反应的△H___0(填“>”“<”或“=”),1050℃达到平衡时H2S的转化率为35%,则该温度下,平衡常数K=___(保留一位有效数字),该温度下Q点时反应___(填“正向移动”“逆向移动”或“不移动”)
Ⅲ.对H2S废气进行利用的另一种途径是将其设计成质子膜—H2S燃料电池,反应原理为2H2S(g)+O2(g)═S2(s)+2H2O(l)。电池结构示意图如图2:
(5)电极a上发生的电极反应式为___。
(6)设NA为阿伏伽德罗常数的值,当电路中通过3mol电子时,通过质子膜进入___(填“正极区”或“负极区”)的H+数目为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com