
科目: 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】在铜锌原电池中(如下图),
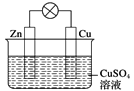
以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式为_______________________________。锌片上观察到的现象为_______;
铜为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式是____;
铜片上观察到的现象是_______________,原电池总反应的离子方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
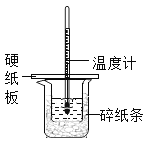
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O俗名为“笑气”,也是一种温室气体。结合所学知识,回答下列问题:
(1)锌与极稀硝酸反应可生成N2O,该反应的化学方程式为___________,其中作氧化剂的硝酸与参与反应的硝酸的物质的量之比为___________。
(2)已知几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | N2(g) | CO2(g) |
相对能量/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
①N2O(g)和CO(g)反应生成N2(g)和CO2(g)的热化学方程式为____________。
②若其他条件不变,加入高效催化剂,该反应的焓变将_______(填“增大”、“减小”或“不变”)。
(3)碘蒸气能催化N2O的分解,反应历程(步骤)如下:
i.I2(g)2I(g)
ii.I(g)+N2O(g)=N2(g)+IO(g)
iii.2IO(g)+2N2O(g)=2N2(g)+2O2(g)+I2(g)
实验表明,在反应过程c(I)始终大于c(IO),由此推测,反应速率ii_________iii(填“>”、“<”或“=”)。
(4)一定温度下,向恒容密闭容器中充入2 mol N2O(g)和3 mol NO(g),发生反应:N2O(g)+NO(g)N2(g)+NO2(g) △H。测得N2体积分数与温度、时间的关系如图所示。

①△H___________0(填“>”、“<”或“=”)。
②下列情况表明该反应达到平衡状态的是___________(填字母)。
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和NO2的消耗速率相等 D.N2O的体积分数不再改变
③T1时,该反应的平衡常数K=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行A(g)+2B(s)![]() 2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 容器内气体平均相对分子质量不变时达到化学平衡状态
C. 温度不变,增大B的投入量,正反应速率增大
D. 温度不变,压缩容器体积重新达到平衡后,A的浓度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.1molL-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
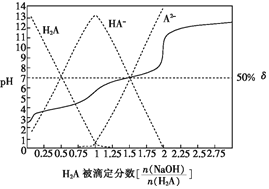
下列说法错误的是( )
A.用NaOH溶液滴定0.1molL-1NaHA溶液可用酚酞作指示剂
B.0.1molL-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
C.0.1molL-1Na2A溶液中:c(Na+)>c(HA-)+2c(A2-)
D.H2A的Ka2=1×10-7
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)![]() 2C(g),已知起始投入4molA(g) 和2 mol B(g),经2 s后测得C的浓度为0.6 mol/L,并且2 s后各组分浓度不再改变。下列说法正确的是
2C(g),已知起始投入4molA(g) 和2 mol B(g),经2 s后测得C的浓度为0.6 mol/L,并且2 s后各组分浓度不再改变。下列说法正确的是
A.2 s内用物质A表示的平均反应速率为0.6 mol/(Ls)
B.2 s内用物质B表示的平均反应速率为0.6 mol/(Ls)
C.2 s后每有0.6 mol的物质B生成,同时就有0.6 mol物质C生成
D.2 s时物质B的浓度为0.7 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是

A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为
D.二茂铁制备过程中阴极的电极反应为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。
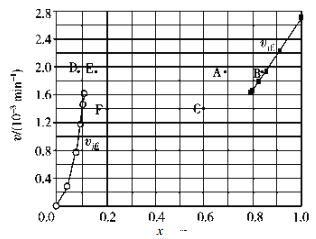
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个2L的密闭容器中,投入反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
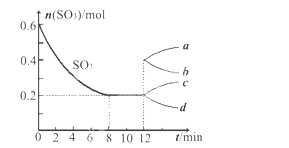
(1)写出该反应的平衡常数表达式并根据8min时到达平衡计算出结果________________。
(2)用O2表示0到8min内该反应的平均速率v=__________________。
(3)升高温度,该反应的K值将______;容器中气体的平均相对分子质量将______。(填“增大”“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是________。
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变
(5)在第12min时,容器压缩到1L,则SO3的变化曲线为_______。
A.a B.b C.c D.d
(6)若保持容积不变在第12min时,加入SO3(g),则平衡向_______反应方向移动(填“正” 或“逆”)。SO3的体积分数_______(填“增大”或“减小”)。
(7)将相同物质的量的SO3充入下面的两个容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应,在反应过程中维持体系温度不变。

①反应达平衡所需时间甲________乙(填“大于”“等于”或“小于”);达平衡时SO3的转化率甲__________乙(“大于”“等于”或“小于”)。
②若平衡后,向甲、乙中分别充入惰性气体,__________(填“甲”或“乙”)容器的平衡将向__________(填“正”或“逆”)反应方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com