
科目: 来源: 题型:
【题目】硫酸镁在工农业生产中有重要的作用。工业上以菱镁矿(主要成分为MgCO3,含少量FeCO3、SiO2等)为原料制备硫酸镁的流程如图:

(1)“酸溶”时MgCO3发生反应的离子方程式为___。
(2)滤渣的成分是___(填化学式)。
(3)加入H2O2氧化时,发生反应的离子方程式为___。
(4)将硫酸镁与木炭在800℃时煅烧,可以得到高纯度的MgO,煅烧过程中存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步收集、吸收或处理。

①装置A中U型管放在冷水中的目的是___,收集的物质是___。
②装置B、C中所盛放的试剂分别是___、___(填化学式)。
③装置D的作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)![]() ETBE(g) △H,回答下列问题:
ETBE(g) △H,回答下列问题:

注:C1表示乙醇和异丁烯同时吸附,C2表示先吸附乙醇,C3表示先吸附异丁烯。
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如上图所示,该反应的△H=____akJ·mol-1,下列选项正确的是______(填序号)。
A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在温度为378 K与388 K时异丁烯的转化率随时间变化如图所示。

①图中A、M、B三点,化学反应速率由大到小的顺序为______,其中逆反应速率最大的点是______(用符号A、M、B填写)。
②388 K时,容器内起始总压为P0 Pa,用分压表示的该反应的平衡常数K=______Pa-1(用含有P0的式子表示)。
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:![]() ,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_____(填序号,k正 、k逆为正、逆速率常数)。
,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_____(填序号,k正 、k逆为正、逆速率常数)。
A.其他条件不变,升高温度,k正增大,k逆变小
B.其他条件不变,使用催化剂,k正、k逆同倍数增大
C.其他条件不变,増大反应物浓度k正增大,k逆不变
D.其他条件不变,减小压强,k正、k逆都变小
已知反应速率υ=υ正-υ逆=k正P(C2H5OH)·P(IB)-k逆P(ETBE),计算上图中M点![]() =_______(保留两位小数)
=_______(保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择合适的完成指定转化。
试剂:S、CO2、Na2CO3溶液、Na3PO4溶液、K2SO4溶液、浓硝酸、浓盐酸
①K2O(一种碱性氧化物)K2CO3的化学方程式:___;
②PH3PO4的化学方程式:___;
③浓硫酸SO2的化学方程式:___。
(2)根据如图所示物质的转化信息书写相应的反应方程式。

①“反应Ⅱ”为复分解反应,写出该反应的化学方程式:___;
②“反应Ⅰ”的产物之一为NaCl,写出该反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用一定浓度的盐酸溶液滴定某氨水溶液。滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是
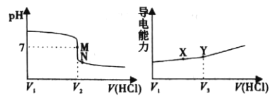
A.M点对应溶液中c(NH4+)=c(Cl-)
B.X→Y溶液导电性增强的主要原因是c(H+)和c(Cl-)增大
C.根据溶液pH和导电能力的变化可判断V2<V3
D.M→N过程中 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气已成为城市空气的主要污染源之一,其中的氮氧化物是重要污染物。
(1)汽车内燃机工作时产生NO的原理如图1所示:

该反应的热化学方程式为______。
(2)治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
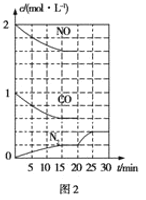
①则从开始到达到平衡状态的过程中,平均反应速率υ(CO2)=____,该温度下反应的平衡常数K=____(结果保留两位有效数字)
②20min时改变的条件可能是____
A.增大压强 C.减小CO2浓度且改用更高效的催化剂
B.降低温度 D.在恒温恒容条件下,充入He气体
③若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将____(填“正向”“逆向”或“不”)移动。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
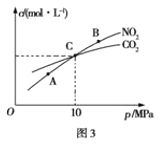
①下列不能说明该反应已达到平衡状态的是_____
a.C的质量不变 b. 混合气体的密度不再发生改变
c. v正(N2)=υ逆(CO2) d.混合气体的颜色不再改变
②计算C点时该反应的平衡常数Kp(C)=___(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质之间有如下反应关系:
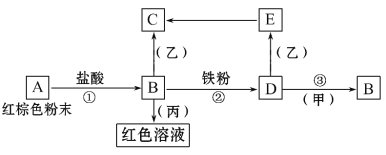
已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:A___,D___,甲___,丙___。
(2)写出红棕色粉末的一种用途___。
(3)写出E→C反应的化学方程式___。
(4)将饱和的B溶液滴入沸水中所得分散系中分散质颗粒直径范围为___。
(5)写出反应②的离子方程式___,该反应中,如果有5.6g铁粉完全反应则生成D的物质的量为___mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氣乙烯进行水体修复,修复过程如图所示。H+、O2、![]() 等共存物的存在会影响水体修复效果。下列说法错误的是
等共存物的存在会影响水体修复效果。下列说法错误的是
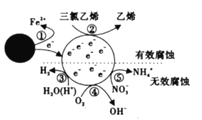
A.反应①在负极发生,反应②③④⑤在正极发生
B.增大单位体积水体中小粒径ZVI的投入量,可加快水体修复速率
C.水体修复过程中,三氯乙烯每脱去3mol Cl,就有3molFe变成Fe2+
D.⑤的电极反应式为![]() + 10H++8e-==
+ 10H++8e-==![]() +3H2O
+3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组设计蔗糖与浓硫酸反应的实验装置如下,并进行系列实验(必要时可对甲适当加热)。下列说法中正确的是
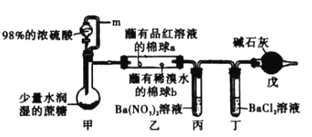
A.可观察到棉球a、b都褪色,且褪色的原理相同
B.丙、丁中都能观察到有白色沉淀生成
C.实验过程中观察到的系列现象,可验证浓硫酸具有吸水性、脱水性和氧化性
D.m管的作用是平衡压强,戊的作用是吸收尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况)。求:
(1)混合物中铁的质量?___
(2)原稀硫酸的物质的量浓度?___
查看答案和解析>>
科目: 来源: 题型:
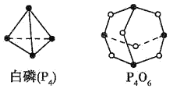
【题目】(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:P-P:198kJ·mol-1,P-O:360 kJ·mol-1,O=O:498kJ·mol-1,则反应P4(白磷)与O2反应生成P4O6的热化学反应方程式为____。
(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式_____。
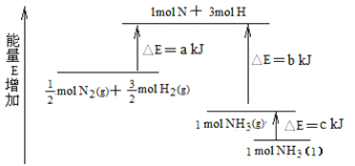
(3)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com