
科目: 来源: 题型:
【题目】已知![]() 表示阿伏加德罗常数的值,下列有关说法正确的是( )
表示阿伏加德罗常数的值,下列有关说法正确的是( )
A.1 mol CnH2n(n≥2)中所含的共用电子对数为(3n+1)NA
B.在12.0 g NaHSO4 和MgSO4混合物中,所含离子数目为0.2NA
C.1 L 1 mol·L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶粒数为NA
D.标准状况下8.96 L D2含有中子数0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】将ag某物质在足量氧气中充分燃烧再将气体生成物通入足量的Na2O2充分反应,固体增重为bg,若a<b,则该物质可能是( )
A. H2B. COC. 乙酸(CH3COOH)D. 甲烷(CH4)
查看答案和解析>>
科目: 来源: 题型:
【题目】纵观古今,化学与生活皆有着密切联系。下列说法正确的是( )
A.《本草图经》在绿矾项记载:“盖此矾色绿,味酸,烧之则赤……”。因为绿矾能电离出H+,所以“味酸”
B.“司南之杓(勺),投之于地,其柢(勺柄)指南”,司南中“杓”的材质为Fe2O3
C.用盐酸能鉴别纯碱和食盐,只用蒸馏水不能。
D.东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”是指硫黄
查看答案和解析>>
科目: 来源: 题型:
【题目】铈是稀土中丰度最高的元素,其在电子材料、催化剂等方面的应用广泛。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈(CeO2),并测定其纯度。其工艺流程如下:

已知:①稀土离子易和SO![]() 形成复盐沉淀:
形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O==== Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为![]() ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)焙烧时,为了提高焙烧效率,可采取的措施有________________________________________
(2)CeFCO3中Ce元素的化合价为___________,滤渣A的主要成分是_____________
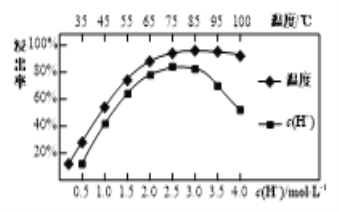
(3)焙烧后加入硫酸浸出,稀土的浸出率和硫酸浓度、温度有关,如图所示,应选择的适宜的条件为___________,硫酸浓度过大时,浸出率减小的原因是__________。
(4)加入硫脲的目的是将Ce4+还原为Ce3+,反应的化学方程式为_________。
(5)步骤③加入盐酸后,通常还需加入H2O2,其主要目的为_________。
(6)步骤④的离子方程式为________________________。
(7)取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+==== Fe3++Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
实验Ⅰ 配制500 mL 一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是____
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为 __,同时洗涤____(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(1)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式 ____;
②提出假设二的可能依据是_____;
③验证假设三是否成立的实验操作是____。
(2)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:
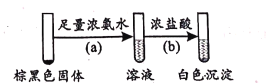
①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为____;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是____(写化学式)。
(3)由上述实验可知,盐溶液间的反应存在多样性。经验证,(1)中实验假设一成立,则(2)中实验的产物不同于(1)实验的条件是 ___。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL 二氧化碳气体(在标准状况下)。求原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是多少?________________
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃,将60g某固体物质(该物质的摩尔质量为Mg·mol-1)完全溶解于水,配制成200mL 密度为1.5g·mL-1的饱和溶液。
(1)20℃时该饱和溶液中溶质的质量分数是___。
(2)20℃时该饱和溶液中溶质的溶解度是__。
(3)溶质的物质的量浓度是____。
查看答案和解析>>
科目: 来源: 题型:
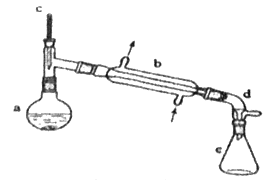
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()
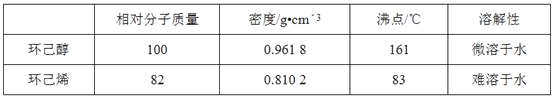
可能用到的有关数据如下:
Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】据研究报道,药物瑞德西韦(Remdesivir)对2019年新型冠状病毒(COVID—19)有明显抑制作用。K为药物合成的中间体,其合成路线如图:
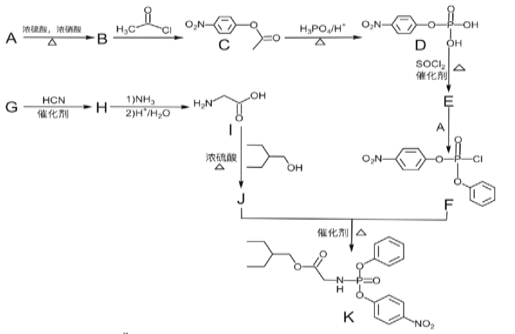
已知:(1)R—OH![]() R—Cl
R—Cl
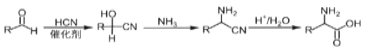
(2)
回答下列问题:
(1)B的化学名称为__。
(2)J中含氧官能团的名称为__。
(3)B到C的反应类型是___,G到H的反应类型是__。
(4)由G生成H的化学反应方程式为___。
(5)E中含两个Cl原子,则E的结构简式___。
(6)X是C同分异构体,写出满足下列条件的X的结构简式___。
①苯环上含有硝基且苯环上只有一种氢原子;②遇FeCl3溶液发生显色反应;③1mol的X与足量金属Na反应可生成2gH2。
(7)参照F的合成路线图,设计由![]() 、SOCl2为原料制备
、SOCl2为原料制备 的合成路线(无机试剂任选)___。
的合成路线(无机试剂任选)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+=X2++Y;(2)Z+2H2O![]() Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
A. X > Y > Z > WB. Y > X > W > Z
C. Z > X > Y > WD. Z > Y > X > W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com