
科目: 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是____。
(2)Fe(OH)3胶体制备的化学方程式为_____。
(3)证明有Fe(OH)3胶体生成利用的胶体性质是_____。
(4)利用Fe(OH)3胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带____(填“正”或“负”)电荷。
②若向其中加入浓盐酸溶液,产生的现象是_____,用必要的文字和有关的离子方程式解释此现象_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组人员用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制1L2.3mol·L-1的稀硫酸。
(1)所配制的稀硫酸中,H+的物质的量浓度与____mol·L-1的NaHSO4溶液中H+的物质的量浓度相同,NaHSO4与氢氧化钡在溶液中反应使溶液呈中性的离子方程式为_____。
(2)需量取浓硫酸的体积为_____mL。
(3)容量瓶使用前应_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于反应CH3COOH(l) + C2H5OH(l) ![]() CH3COOC2H5(l) + H2O(l) ΔH=-2.7kJ·mol-1,下列说法正确的是
CH3COOC2H5(l) + H2O(l) ΔH=-2.7kJ·mol-1,下列说法正确的是
A.由于水为液态,移走生成的水平衡不会移动。
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
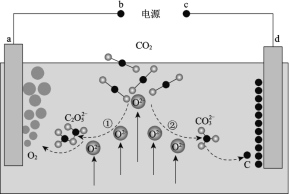
下列说法不正确的是
A.c为电源的负极
B.①②中,捕获CO2时碳元素的化合价均未发生变化
C.d极的电极反应式为![]() + 4e = C + 3O2
+ 4e = C + 3O2
D.转移1mol电子可捕获CO2 2.8 L(标况下)
查看答案和解析>>
科目: 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.将0.1 mol·L-1 CH3COOH溶液从20 ℃升温至30 ℃,溶液中c(H+)/c(CH3COOH)减小
B.若NH4Cl溶液与NH4HSO4溶液的pH相等,则c(NH![]() )也相等
)也相等
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年以来,新型冠状病毒肺炎席卷全世界,中国传统中药“连花清瘟胶囊”助力世界抗疫。连花清瘟胶囊配方中含传统中药金银花,绿原酸是金银花主要抗菌、抗病毒有效药理成分之一,结构简式如下图所示。关于绿原酸的下列推测不合理的是
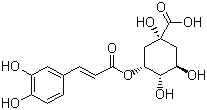
A.分子中有4个手性碳原子B.可溶于水也可溶于乙醇
C.1mol最多可和3mol NaOH反应D.可通过缩聚反应形成高分子
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验需要450mL0.10mol·L-1Na2CO3溶液,某同学选用Na2CO3·10H2O 晶体进行配制,简要回答下列问题:
(1)该实验应选择____mL容量瓶。
(2)需称取Na2CO3·10H2O的质量为_____g。
(3)该实验的正确操作顺序是_____(填字母代号)。
A.用托盘天平称取Na2CO3·10H2O晶体
B.上下颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器并将洗涤液转移进容量瓶
E.将所称取的晶体溶于蒸馏水并冷却至室温
F.将溶液转入容量瓶
(4)下列操作对溶液浓度有何影响(填“偏高”、“偏低”或“无影响”)。
①若容量瓶中有检漏时残留的少量蒸馏水,会使所配溶液浓度_____;
②配制过程中未洗涤烧杯和玻璃棒,会使浓度_____;
③NaOH溶解后未经冷却立即注入容量瓶至刻度线,会使浓度____;
④定容时必须使凹液面最低处与刻度线相切,若仰视会使所配溶液浓度_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。
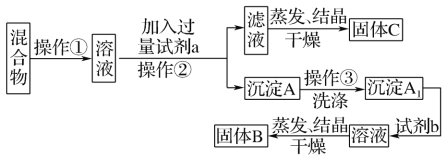
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。试回答下列问题:
(1)操作①的名称是____,操作②的名称是____。
(2)试剂a是_____(填化学式,下同),试剂b是____,固体B是____。
(3)加入试剂a所发生反应的化学方程式为_____。加入试剂b所发生反应的离子方程式为_____。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进?_____(若能,此问不用回答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com