
科目: 来源: 题型:
【题目】在一定温度下的2L密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g),达到平衡时,各物质的平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c (Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
2Z(g),达到平衡时,各物质的平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c (Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
(1)若在恒温恒容条件下进行反应X(g)+Y(g)![]() 2Z(g),可判断该反应达到化学平衡状态的是_____
2Z(g),可判断该反应达到化学平衡状态的是_____
A.单位时间内生成n molX的同时生成2nmolZ
B.密闭容器中密度不再改变的状态
C.用X、Y、Z的物质的量浓度变化表示反应速率的比为1∶1∶2的状态
D.反应容器中Y的物质的量分数不再改变的状态
E.密闭容器中压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(2)a、b应满足的关系是_________。
(3)a的取值范围是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学小组实验探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。_____I-+___Fe3+![]() ______I2+_______Fe2+
______I2+_______Fe2+
(2)步骤ⅲ中,试剂X是_____________。
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种防止血栓形成与发展的药物J的合成路线如图所示(部分反应条件略去):
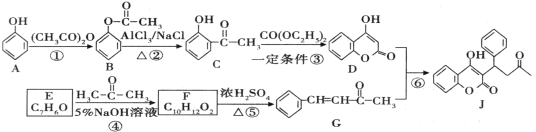
回答下列问题:
(1)A中官能团的名称是________________,反应⑤的反应类型是_________________。
(2)J的分子式是_______________。F的结构简式是________________________。
(3)反应③的化学方程式为________________________。
(4)已知C有多种同分异构体。写出同时满足下列条件的C的同分异构体的结构简式______(只需写出两个):
①苯环上有两个处于对位上的取代基;②1mol该有机物与足量金属钠反应生成1g氢气。
(5)请参照J的合成方法,写出以![]() 为原料制备
为原料制备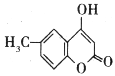 的合成路线:
的合成路线:
___________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
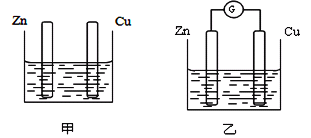
(1)以下叙述中,正确的是________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为________;乙为____________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______________________ 。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应式__________________。当电路中转移0.2 mol电子时,消耗负极材料的质量为_________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知HCO3﹣+AlO2﹣+H2O═CO32﹣+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
A. 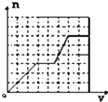 B.
B. 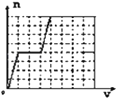 C.
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】探究NaHSO3溶液分别与CuCl2、CuSO4溶液的反应。

已知:①![]() (深蓝色溶液)
(深蓝色溶液)
②![]()
回答下列问题:
(1)实验Ⅰ产生的无色气体为SO2。用蘸有碘水的淀粉试纸接近试管口,观察到_________________________,反应的离子方程式为______________________。
(2)对实验Ⅰ产生SO2的原因进行分析,提出两种假设:
①Cu2+水解使溶液中c(H+)增大;
②Cl-存在时,Cu2+与![]() 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
实验证明,①不合理,实验证据是____________________;②合理,实验Ⅰ反应的离子方程式有_________________________、H++![]() =SO2↑+H2O。
=SO2↑+H2O。
(3)通过分析实验Ⅰ、Ⅱ,可知:Cl-增强了Cu2+的氧化性。下述实验证实了此结论。实验方案:闭合K,电压表的指针偏转至“x”处;向U形管___________(补全实验操作及现象)。装置中,盐桥的作用是______________________________(答出两条即可)。
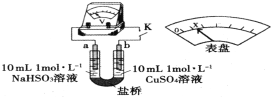
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和![]() 。设计实验,证明红色沉淀中含有Cu+__________________。
。设计实验,证明红色沉淀中含有Cu+__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验过程中产生的现象与对应的图形符合的是

A.盐酸溶液中加入NaAlO2
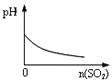
B.SO2气体通入溴水中

C.pH=2的醋酸与盐酸溶液分别加水稀释

D.氨气通入醋酸溶液中
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在体积为![]() 的密闭容器中,存在关系
的密闭容器中,存在关系![]() ,反应物和生成物的物质的量随时间变化的关系如图所示。下列说法正确的是( )
,反应物和生成物的物质的量随时间变化的关系如图所示。下列说法正确的是( )
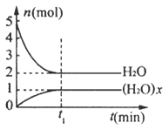
A. ![]()
B. 该温度下,反应的平衡常数为![]()
C. 平衡时混合气体的平均摩尔质量是![]()
D. ![]() 时刻,保持温度不变,再充入
时刻,保持温度不变,再充入![]() ,重新达到平衡时,
,重新达到平衡时,![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应与能量的说法正确的是
A.Zn(s)+CuSO4(aq)![]() ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
ZnSO4(aq)+Cu(s) ΔH=216 kJ/mol:E反应物<E生成物
B.CaCO3(s)![]() CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
CaO(s)+CO2(g) ΔH=+178.2 kJ/mol:E反应物<E生成物
C.HCl(g)![]()
![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
Cl2(g) ΔH=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量
D.H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
H2O(l) ΔH=57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】磷能形成多种单质或化合物。回答下列问题:
(1)白磷(P4)在氯气中燃烧产生大量白色烟雾,生成PCl3和PCl5。
①P4化学性质比N2活泼的主要原因是___________________________。
②形成PCl5时,P原子的一个3s电子激发到3d轨道后参与成键。写出该激发态原子的外围电子轨道表示式___________________________________。
③PCl5是一种白色固体,加压下于148℃液化,形成离子导体,其中阳离子为正四面体结构,阴离子为正八面体结构,该离子导体能导电的原因是_______(用电离方程式解释)。
(2)新型半导体材料 黑磷,是一种二维材料(结构如下图甲所示),其单层的结构如下图乙所示。
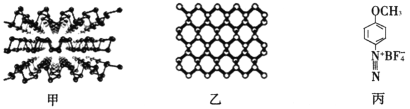
①黑磷中P原子的杂化方式为_____________________________。
②用4-甲氧基重氮苯四氟硼酸盐(如上图丙所示)处理黑磷纳米材料,可以保护和控制其性质。该盐的构成元素中N、O、F的电负性由大到小顺序为__________________,1mol该盐的阳离子含有的σ键的数目为____________(阿伏加德罗常数的值用NA表示,下同)。
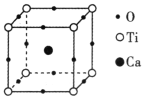
(3)中国科学院深圳先进技术研究院在钙钛矿/黑磷纳米复合材料的研究领域取得新进展,该材料表现出优异的光电应用潜力。如图所示为高温超导领域里的一种化合物 钙钛矿晶胞结构。若图中正方体边长为a nm,则该晶体的密度为____________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com