
科目: 来源: 题型:
【题目】过硫酸钠(Na2S2O8)也叫高硫酸钠、过二硫酸钠,是白色晶状粉末,易溶于水,加热至65℃就会发生分解,用作漂白剂、氧化剂、乳液聚合促进剂。某化学小组对Na2S2O8制备和性质进行探究。
I.实验室制备Na2S2O8
(查阅资料)工业制备过硫酸钠的反应原理:
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
设计如图实验装置:
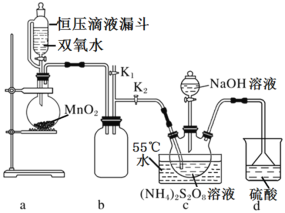
(1)恒压滴液漏斗的优点是___。
(2)装置a中反应产生的气体需要持续通入装置c的目的是___;装置b、d的作用分别是___、___。
(3)反应完毕,将三颈圆底烧瓶中的溶液减压浓缩、结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是___。
II.探究Na2S2O8的性质
(1)酸性过硫酸钠溶液,在Ag+催化作用下可以把Mn2+氧化为MnO4-,该方法可用于检验Mn2+,所得溶液除去Ag+后加入BaCl2溶液可以产生白色沉淀。
①用酸性Na2S2O8溶液检验Mn2+时的实验现象为___。
②该反应的离子方程式为____。
(2)过硫酸钠溶液与铜反应只生成两种盐且反应先慢后快,某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用,设计实验方案检验该推测是否正确___。(供选择试剂:Cu、Na2S2O8溶液、Na2SO4溶液、CuSO4溶液、Cu(NO3)2溶液、CuCl2溶液、蒸馏水)
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液![]() A和食盐的饱和溶液
A和食盐的饱和溶液![]() 悬浊液
悬浊液![]() 晶体
晶体![]() 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一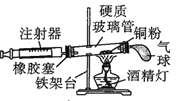 装置二
装置二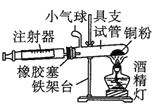
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲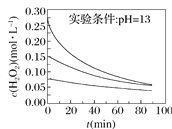 图乙
图乙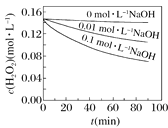
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。
查看答案和解析>>
科目: 来源: 题型:
【题目】尼洛替尼用于治疗白血病有显著疗效。有机化合物M(![]() )是合成尼洛替尼的中间体,其一种合成路线如图:
)是合成尼洛替尼的中间体,其一种合成路线如图:

已知:含有α—氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β—酮酸酯。如:
2CH3COOC2H5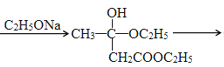 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
回答下列问题:
(1)有机物A中含氧官能团的名称为___。
(2)M的分子中最多有___个碳原子在同一个平面上,M存在顺反异构现象,其反式异构体的结构简式是___。
(3)反应①的化学方程式为___;其反应类型为___。
(4)有机物![]() 有多种同分异构体,其中含有苯环的硝基化合物有___种,写出其中一种具有手性碳的同分异构体的结构简式为___。
有多种同分异构体,其中含有苯环的硝基化合物有___种,写出其中一种具有手性碳的同分异构体的结构简式为___。
(5)写出以乙醇、乙酸、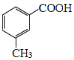 为原料合成
为原料合成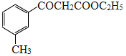 的合成路线(其它试剂任选)___。
的合成路线(其它试剂任选)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定量的铁、氧化亚铁和氧化铁的混合粉末中,加入100ml2mol/L的盐酸,恰好使混合物完全溶解,并放出448ml的气体(SPT),在所得溶液中加入KSCN溶液无血红色出现.若用相同质量的上述混合物粉末高温下同足量的一氧化碳反应,可得到铁的质量是( )
A.无法计算B.2.8gC.5.6gD.11.2g
查看答案和解析>>
科目: 来源: 题型:
【题目】小苏打、胃舒平都是常用的中和胃酸的药物,完成下列填空:
(1)小苏打片每片含0.42gNaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子物质的量是__mol。
(2)胃舒平每片含0.195gAl(OH)3,中和胃酸时,3片小苏打片相当于胃舒平__片。
(3)将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据计算:
①原合金中镁和铝的质量___、___。
②盐酸的物质的量浓度___。

查看答案和解析>>
科目: 来源: 题型:
【题目】用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入__。
(2)除去蒸馏水中溶解的O2常采用___的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是__。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
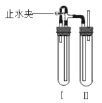
(1)在试管I里加入的试剂是___。
(2)在试管II里加入的试剂是___。
(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:先___,后__。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
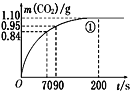
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1 | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(3)表中V1=_______mL,V2=_______mL。
(4)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于一定条件下的化学平衡H2(g)+I2(g)![]() 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
A.恒温恒容,充入H2,v(正)增大,平衡右移
B.恒温恒容,充入He,v(正)增大,平衡右移
C.加压,v(正),v(逆)不变,平衡不移动
D.升温,v(正)减小,v(逆)增大,平衡左移
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是指导我们系统学习化学的重要工具。(答案都填写化学式)
(1)如图是铁元素在元素周期表中的有关信息。

写出Fe的原子结构示意图__,自然界中存在的54Fe和56Fe,它们互称为___。将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是__。通常证明某溶液中含Fe2+的化学方法是___。
下表是元素周期表的一部分:
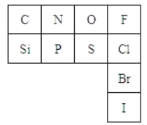
(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的__相同。处于同一列的N和P位于元素周期表的__族。
(3)通过元素周期表,我们可以知道:
①氮元素的最低化合价为_,其气态氢化物的结构式为__。
②与硅元素处于同一周期,两性金属元素是__,并写出其在元素周期表中的位置:第__周期,__族,该元素的最高价氧化物对应水化物的电离方程式为__。
③第三周期半径最大的金属元素__,该元素形成氢氧化物的电子式_,检验物质中是否含有该元素的方法是:__。
④在上表所列元素的最高价氧化物对应水化物中酸性最强的是__(写化学式)。该元素与硫元素相比,非金属性较强的元素是__(填元素符号),请写出证明该结论的一个实验事实:__。
⑤如图,将潮湿的Cl2单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是___。
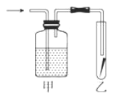
a.浓硫酸 b.NaOH溶液 c.KI溶液 d.饱和食盐水
⑥由于氢元素的化合价,有人提议还可以将其放在第__族,又有人提议可将它放在周期表中第IVA族,这样建议的原因是__。
⑦科学家通过对某些元素的化合价进行研究,寻找高效农药。这些元素往往位于元素周期表的__(选填序号)。
a.左下角区域 b.右上角区域 c.左上角区域 d.右下角区域
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com