
科目: 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-,HB- ![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1)Na2B溶液显________(填“酸性”“中性”或“碱性”)。理由是______(用离子方程式表示)。
(2)若0.1mol·L-1的NaHB溶液PH=2,则0.1mol/LH2B溶液中氢离子浓度可能是_________0.11mol/L(填“﹥”“=” 或“﹤”) ,理由是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H=akJ/mol,平衡常数为K;测得在不同温度下,K值如下:
FeO(s)+CO(g) △H=akJ/mol,平衡常数为K;测得在不同温度下,K值如下:
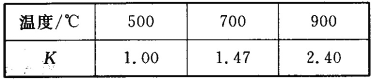
(1)若500℃时进行上述反应,CO2起始浓度为1 mol/L,CO的平衡浓度为_____。
(2)方程式中的a________0(填“大于”“小于”或“等于”)。
(3)900℃上述反应达到平衡,要使得该平衡向左移动,其他条件不变时,可以采取的措施有________(填序号)
A.缩小反应器体积 B.加入FeO
C.降低温度到500℃ D.使用合适的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请回答以下问题。
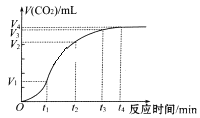
(1)化学反应速率最快的时间段是_________,原因是________________。
A.0~t1 B.t1-t2 C. t2~t3 D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有_________。
A.蒸馏水 B.NaCl固体
C.NaCl溶液 D.通入HCl
(3)若盐酸溶液的体积是20mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率v(HCl)=________________mol·L-1·min-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】由镁、铝、铁三种金属单质中的两种组成的混合物共6g,与足量的稀盐酸反应,产生标准状况下的氢气2.8L,由此得出的结论正确的是( )
A.该混合物中一定含有铝B.该混合物中一定含有铁
C.该混合物一定是由铁和镁组成的D.该混合物中一定不含铁
查看答案和解析>>
科目: 来源: 题型:
【题目】将10molA和5molB放入容积为10L的密闭容器中,某温度下发生反应:3A(g)+B(g)![]() 2C(g),在最初2s内,消耗A的平均速率为0.09mol·L-1·s-1,则在2s时,
2C(g),在最初2s内,消耗A的平均速率为0.09mol·L-1·s-1,则在2s时,
(1)容器中有___________molA;
(2)此时C的物质的量浓度为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
B.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.PO43-+H3O+ ![]() HPO42-+H2O
HPO42-+H2O
D.H2O+H2O![]() H3O++OH-
H3O++OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】“臭碱![]() ”广泛应用于冶金染料、皮革、电镀等工业,可利用反应
”广泛应用于冶金染料、皮革、电镀等工业,可利用反应![]() 制备。已知
制备。已知![]() ,
,![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.反应中生成1 mol“臭碱”时转移电子数为![]()
B.该反应的氧化产物与还原产物的物质的量比为![]()
C.![]() 溶液中含有的阴离子数目大于
溶液中含有的阴离子数目大于![]()
D.将![]() 溶液露置于空气中不会有
溶液露置于空气中不会有![]() 气体放出
气体放出
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2CO3溶液中存在水解平衡:CO32-+H2O ![]() HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是
A.加水稀释,溶液中所有离子的浓度都减小
B.通入CO2,溶液pH增大
C.加入NaOH固体,c(HCO3-)/c(CO32-)减小
D.升高温度,平衡常数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种超原子![]() 具有40个价电子,下列说法错误的是( )
具有40个价电子,下列说法错误的是( )
A.![]() 的空间构型为平面三角形
的空间构型为平面三角形
B.简单离子半径:![]()
C.![]() 中心原子的杂化方式为
中心原子的杂化方式为![]() 杂化
杂化
D.化合物ZY的结构与X的某种单质的结构相似
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com