
科目: 来源: 题型:
【题目】以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )

A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属Cu。根据流程图,下列说法不正确的是
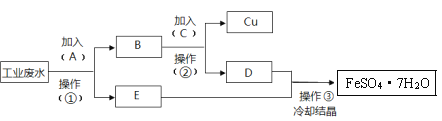
A.①②操作均为过滤,但D、E溶液成分不完全相同
B.C可以为稀硫酸,也可以是稀盐酸
C.操作③采用冷却结晶,说明硫酸亚铁晶体的溶解度随温度变化有一定变化
D.A为足量铁粉,其反应的离子方程式为:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )
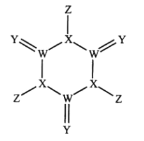
A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
查看答案和解析>>
科目: 来源: 题型:
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(Ⅲ)和V(Ⅳ)形式存在,由含钒石煤提钒的一种工艺流程如下所示:

已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
(1)含钒石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为______________。

(2)下图为“抽滤”实验原理装置图,“抽滤”时抽气泵的作用是______________;

(3)已知酸浸液中![]() 被
被![]() 氧化成
氧化成![]() ,其离子方程式为___________________。“净化除杂”时用铜铁试剂除去所含的
,其离子方程式为___________________。“净化除杂”时用铜铁试剂除去所含的![]() 、
、![]() 等杂质离子而不通过调节酸浸液pH的原因是_________________________________________________________。
等杂质离子而不通过调节酸浸液pH的原因是_________________________________________________________。
(4)“沉钒”的离子反应方程式为___________________。
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%),则A点对应物质的化学式为________________________,B点对应的物质为![]() ,则B点坐标为________________。
,则B点坐标为________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知A,B,C,D都是周期表中的短周期元素,它们的核电荷数依次增大。A原子,C原子的L能层中,都有两个未成对的电子,C,D同主族。E,F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号___,该能层具有的原子轨道数为__;
(2)E2+离子的价层电子排布图是__;
(3)A的最高价氧化物对应的水化物,其中心原子采取的轨道杂化方式为__,B的气态氢化物的VSEPR模型为__。
(4)DAB-的电子式为___;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6。甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
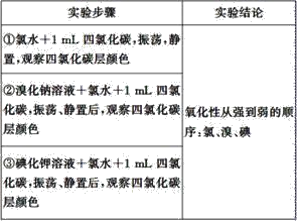
实验药品:溴化钠溶液、碘化钾溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是__、__。
(2)②中反应的化学方程式为__;③中反应的离子方程式为__。
(3)四氯化碳在实验中所起的作用是__。
(4)该同学的实验设计不足之处是__,改进的办法是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D 4种元素,前3种元素的离子都和氖原子具有相同的核外电子排布。A元素没有正化合价;B的氢化物分子式为H2B。0.2 mol的C单质能从酸中置换出2.24 L H2(标准状况)。D的原子核中没有中子。
(1)根据以上条件,判断A、B、C、D的元素名称:
A________,B________,C________,D________。
(2)用电子式表示C与A、C与B、B与D相互结合成的化合物,指出其化合物的类型及化学键类型:
①C+A2:电子式____________,化合物类型__________,化学键类型____________;
②C+B2:电子式____________,化合物类型__________,化学键类型____________;
③B+D2:电子式____________,化合物类型__________,化学键类型____________;
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
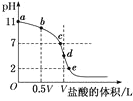
(1)该温度时NH3·H2O的电离常数K=__;
(2)比较b、c、d三点时的溶液中,由水电离出的OH-浓度大小顺序为__;
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是__(填字母,下同);
A.c(H+)·c(OH-) B.![]() C.
C.![]() D.
D.![]()
(4)根据以上滴定曲线,下列说法正确的是__;
A.点b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=___,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:

下列对实验的分析不合理的是
A.实验1中,白烟是NH4Cl
B.根据实验1、2,可以判断还原性:Br->Cl-
C.根据实验3,可以判断还原性:I->Br-
D.上述实验体现了浓硫酸的强氧化性、难挥发性等性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com