
科目: 来源: 题型:
【题目】他米巴罗汀(I)可用于治疗急性白血病,其合成研究具有重要意义,合成路线如图所示。
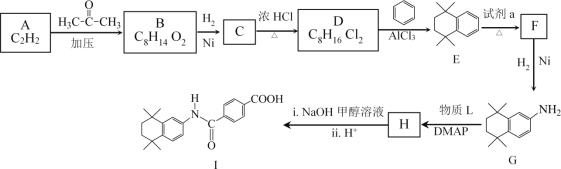
已知:i.HC![]() CH+
CH+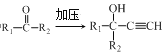
ii.R—NO2![]() R—NH2
R—NH2
iii.R1—NH2+![]() +HCl
+HCl
(1)A中官能团名称是_________。
(2)B的结构简式是________。
(3)D→E的化学方程式是__________。
(4)试剂a是_________。
(5)已知H在合成I的同时,还生成甲醇,G→H所加物质L的结构简式是______。
(6)B的一种同分异构体符合下列条件,其结构简式是________。
①能发生银镜反应
②核磁共振氢谱只有两组吸收峰
(7)D→E的过程中有多种副产物,其中属于高分子化合物的结构简式是_______。
(8)![]() 也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。
也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】I.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
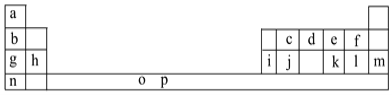
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___。
(2)d与a反应的产物的分子中中心原子的杂化形式为___,该分子是___(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___。
II.(1)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为__。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为___。S8易溶于二硫化碳的原因是___。
![]()
(2)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
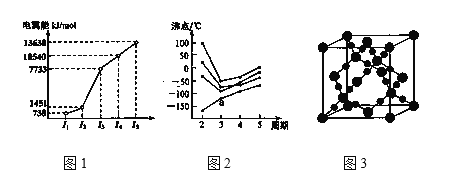
①第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___种不同运动状态的电子。
②CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___晶体。
③如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是__。判断依据___。
查看答案和解析>>
科目: 来源: 题型:
【题目】I-测定的基本原理是将其氧化成I2,再用Na2S2O3标准溶液来滴定。如果样品中仅含有微量I-,必须用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是化学放大反应的实验步骤:
I.将含有微量I-的样品溶液调至中性或弱酸性,加入溴水,将I-完全氧化成IO![]() ,煮沸去掉过量的溴;
,煮沸去掉过量的溴;
Ⅱ.取上述溶液,加入过量硫酸酸化的KI溶液,振荡,溶液颜色呈棕黄色;
Ⅲ.将Ⅱ所得溶液中全部的I2萃取至CCl4中;
Ⅳ.向分液后的CCl4溶液中加入肼(N2H4)的水溶液,产生无毒的N2,分去有机层;
V.将Ⅳ所得水溶液重复I、Ⅱ步骤;
Ⅵ.以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。已知:反应为:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() ;Na2S2O3和Na2S4O6溶液颜色均为无色。
;Na2S2O3和Na2S4O6溶液颜色均为无色。
(1)I中氧化剂和还原剂物质的量之比为______。
(2)Ⅲ中使用的主要玻璃仪器是______(填名称)。
(3)Ⅳ中反应的离子方程式是______。
(4)Ⅵ中需要在中性或弱酸性环境中进行,pH过大,Na2S2O3易被I2氧化成Na2SO4,其离子方程式为_______;结合离子方程式解释pH不宜过小的原因:______。VI中滴定终点的现象是______。
(5)样品中I-最终所消耗的Na2S2O3的物质的量与样品中初始I-物质的量的比值称为“放大倍数”。经过以上操作,放大倍数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】三草酸合铁酸钾[K3Fe(C2O4)33H2O]是制备负载型活性铁催化剂的主要原料。某化学小组探究用废铁屑(含少量-2价S元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体。具体流程如图:
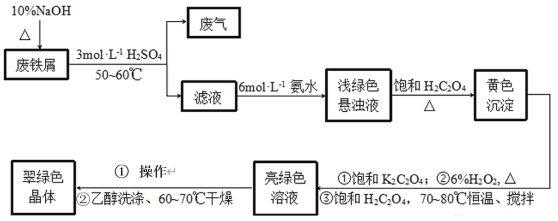
已知:①(NH4)2Fe(SO4)26H2O为蓝绿色晶体,FeC2O4·2H2O为难溶于水的黄色晶体,K3Fe(C2O4)3·3H2O为可溶于水、难溶于乙醇的翠绿色晶体。
②25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O![]() (aq) K=6.31×10-17。
(aq) K=6.31×10-17。
③[Fe(SCN)]2+(aq)为血红色。
回答下列问题:
(1)三草酸合铁酸钾[K3Fe(C2O4)33H2O]中铁的化合价是_____。
(2)废铁屑中加入10%NaOH并加热的目的是__。
(3)为防止污染空气,反应所产生的“废气”可选择__净化处理。(填选项)
A.H2O B.NaOH溶液 C.盐酸 D.CuSO4溶液
(4)写出浅绿色悬浊液中加入饱和H2C2O4生成黄色沉淀的化学方程式:__。
(5)制备过程中加入6%H2O2的目的是__,温度保持70~80℃,采用的合适加热方式是__。
(6)获得翠绿晶体的操作①是___。
(7)用乙醇洗涤晶体的原因是___。
(8)某同学欲检验所制晶体中的Fe(Ⅲ),取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1molL-1KSCN溶液。请判断上述实验方案是否可行并说明理由:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组欲探究醛的银镜反应用银氨溶液而不直接用AgNO3溶液的原因。
(一)甲同学进行了如下对比实验:
装置 | 实验序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 2%AgNO3溶液1mL,加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 | 光亮的银镜 |
实验Ⅱ | 2%AgNO3溶液1mL,加入3滴新开瓶的40%的乙醛溶液;水浴加热3分钟 | 无明显现象 |
(1)乙醛发生银镜反应的化学方程式为_____。
(2)甲同学认为:2%AgNO3溶液应该比用其配制的银氨溶液更易氧化乙醛,可能的理由是_____(写出一条即可);而实验Ⅱ中无明显现象,从化学反应原理的角度解释可能的原因_____(写出一条即可)。
(二)乙同学为了找到银镜反应用银氨溶液的真正原因,先查阅资料,发现醛银镜反应的机理分为如下三步:

(3)据此,乙设计了更好的银镜实验III:2%AgNO3溶液1mL,加入3滴1mol/LNaOH溶液,再加入2%氨水22滴;再加入3滴新开瓶的40%的乙醛溶液;水浴加热,很快出现了银镜。
(4)乙根据实验III并结合反应机理中出现银镜的分步机理(3),得出的结论是_____。
(三)丙同学为了确认AgNO3溶液能氧化醛,继续查找资料,找到了不同浓度的AgNO3溶液对室内HCHO气体去除效果如图。
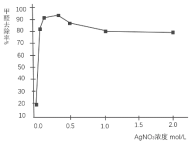
(5)从图中可见:AgNO3溶液浓度达到一定程度,HCHO的去除率基本不变,原因是AgNO3溶液浓度越高,酸性越强,降低了______的还原性;同时,说明了AgNO3溶液和HCHO反应的氧化剂不是______。
(四)结合甲乙丙的实验和资料,丁同学进一步提出,溶液的pH稳定,有利于快速形成均匀光亮的银镜。
(6)请结合化学用语解释AgNO3溶液与乙醛溶液的反应pH变化明显,而银氨溶液变化不明显_____。
(7)综合该实验小组四位同学的实验和论证,最后得出银镜反应用银氨溶液,而不是AgNO3溶液的优点是_____(写出2条即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、T、Q、Z 五种元素,位于元素周期表前四周期,元素的性质或结构信息如表:
元素 | 性质或结构信息 |
X | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
Y | 基态原子的3p轨道上有4个电子 |
T | 原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 |
Q | 第三周期主族元素中原子半径最小 |
Z | 基态原子的2价阳离子M层轨道全部排满电子 |
请根据上述信息回答下列问题:
(1)写出X3-的一种等电子体的化学式___;
(2)写出T元素基态原子的核外电子排布图___;
(3)元素X、T的电负性相比,___的小(填元素名称);元素X的第一电离能与T相比较,T的___(填“大”或“小”)。
(4)①Z元素在周期表中位于__区。Z单质晶体中Z原子在三维空间里的堆积方式为___堆积。
②Z的氯化物与氨水反应可形成配合物[Z(NH3)4(H2O)2]Cl2,该配合物加热时,首先失去配离中的配体是___(写化学式)。
(5)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为___,分子中X原子的杂化方式为___杂化。
(6)Y与Z所形成化合物晶体的晶胞如图所示,该化合物的化学式为___。
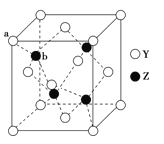
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①与SO42-互为等电子体的分子有___(写一种)。
②ClO2-中氯原子的孤电子对数为___。
③常用K3[Fe(CN)6]检验水中的Fe2+。K3[Fe(CN)6]的配体是___。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2__(填“>”“<”或“=”)Cl2O,理由是___。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(1)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了___。
,这样的书写不正确,违背了___。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是___。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为___。
(3)研究发现,阳离子的颜色与未成对电子数有关。例如Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如图。
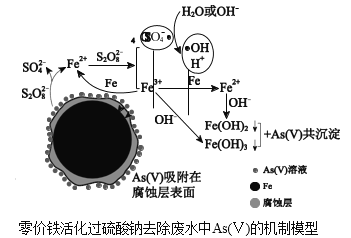
资料:
Ⅰ.酸性条件下SO![]() 为主要的自由基,中性及弱碱性条件下SO
为主要的自由基,中性及弱碱性条件下SO![]() ·和·OH同时存在,强碱性条件下·OH为主要的自由基。
·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
①砷在元素周期表中的位置是_____。
②砷酸的化学式是_____,其酸性比H3PO4_____(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O![]() 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①零价铁与过硫酸钠反应的离子方程式是_____。
②Fe3+转化为Fe2+的离子方程式是_____。
③SO![]() ·和H2O反应的离子方程式是_____。
·和H2O反应的离子方程式是_____。
(3)不同pH对As(Ⅴ)去除率的影响如图。5min内pH=7和pH=9时去除率高的原因是_____。
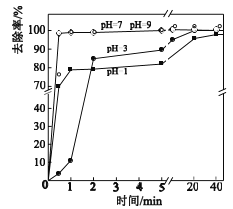
查看答案和解析>>
科目: 来源: 题型:
【题目】新春佳节少不了饮酒,土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒须加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.抗氧化 B. 氧化细菌 C.增酸作用 D. 漂白
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图的实验:

(2)甲同学得出实验结论: 干白葡萄酒中不含SO2或H2SO3。这个结论是否合理?说明理由___________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
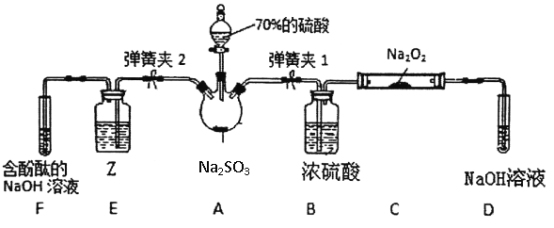
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出A装置反应的化学方程式______,C中每消耗2molNa2O2,则转移电子数___________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂可以是____,反应的离子反应方程式为____________,现象是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com