
科目: 来源: 题型:
【题目】锂/氟化碳电池稳定性很高。电解质为LiClO4的二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )
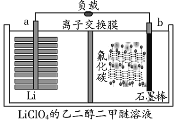
A.交换膜为阴离子交换膜
B.正极的电极反应式为CFx+xe-+xLi+=xLiF+C
C.电解质溶液可用LiClO4的乙醇溶液代替
D.a极电势高于b极电势
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
除去SO2中的少量HCl | 实验室制取并收集氨气 | 苯萃取碘水中的I2分出水层后的操作 | 实验室制备乙酸乙酯 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 6.02×1023就是阿伏加德罗常数
B. 1 mol水中的氢原子数目为2NA
C. 阿伏加德罗常数个粒子的物质的量是1 mol
D. 1 mol 氨气所含原子数约为2.408×1024个
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(?) ![]() zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
A. 各物质的计量数一定满足:x+y=z
B. 若B为气体,压缩后B的体积分数增大,转化率降低
C. 无论B为固体或气体,压缩后B的质量都不会改变
D. 压缩时,平衡向逆反应方向移动,且正、逆反应速率都增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某恒温恒容密闭容器中存在反应:X(g)+2Y(g)![]() Z(g) ΔH=-akJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
Z(g) ΔH=-akJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
A.体系中混合气体的总压强保持不变时,说明该反应达到化学平衡状态
B.达到平衡时,反应放出的热量一定小于akJ
C.达到平衡时,X与Y的物质的量之比仍为1∶1
D.达到平衡后,若升高体系温度,则逆反应速率增大、正反应速率减小,平衡逆移
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如图所示实验装置进行钠和水反应的实验,据此判断下列说法中正确的是( )

A.打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升进入长颈漏斗,a处有无色气体产生
D.若用苯或酒精代替煤油,可观察到相同的实验现象
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
B.0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1NA
C.1 L 0.5 mol·L-1醋酸钠溶液中阴、阳离子总数目大于NA
D.0.1 mol环氧乙烷(![]() )中含有共价键的总数约为0.3×6.02×1023
)中含有共价键的总数约为0.3×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )

A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com