
科目: 来源: 题型:
【题目】2020年5月1日北京市在全市范围内开展施行垃圾分类,下列垃圾分类不正确是( )
A.鱼骨、菜叶 | B.消毒剂及其包装物 | C.破损的易拉罐 | D.破碎玻璃 |
|
|
|
|
厨余垃圾 | 有害垃圾 | 可回收垃圾 | 其他垃圾 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列说法正确的是
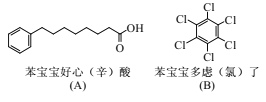
A. 化合物(A)不能与乙醇发生反应
B. 化合物(B)分子式为C6H6Cl6
C. 化合物(B)可通过苯与Cl2发生加成反应制得
D. 1mol化合物(A)可与3molH2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】今年6月比亚迪正式发布刀片电池,大幅度提高了电动汽车的续航里程可媲美特斯拉,刀片电池采用磷酸铁锂技术。可利用钛铁矿[主要成分为FeTiO3(难溶性亚铁盐),还含有少量MgO等杂质]来制备LiFePO4和Li4Ti5O12等锂离子电池的电极材料,工艺流程如图:
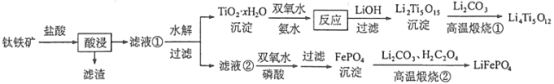
回答下列问题:
(1)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式 _______。
(2)TiO2xH2O沉淀与双氧水、氨水“反应”转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示:
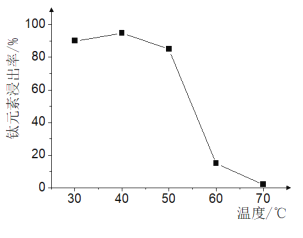
反应温度过高时,Ti元素浸出率变化的原因是 ________。
(3)“滤液②”中含有的金属离子是 _______;加入双氧水和磷酸使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时溶液中 c(PO43-)=________。(FePO4的 Ksp=1.3×10 -22)
(4)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
(5)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为_____。
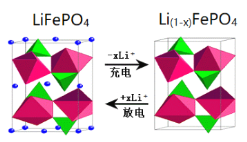
(6)作为刀片电池正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,则正极电极反应式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于NA下列说法正确的是
A. 常温常压下,17g羟基(—18OH)所含中子数为9NA
B. 0.1mol NH3溶于水形成的溶液中,微粒NH3·H2O和微粒NH4+的数目之和为0.1NA
C. 常温下电解饱和食盐水,当溶液pH值由7变为12时,电路中转移的电子数为0.01NA
D. 标准状况下,足量的甲烷与22.4LCl2(假设氯气完全反应)在光照条件下发生取代反应,形成C-Cl键的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学工厂产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等离子。综合利用该酸洗废液的工艺流程如下:
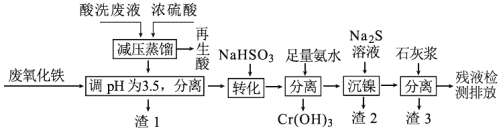
已知:①Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
②金属离子开始沉淀和沉淀完全时的pH表③Ksp(CaF2)=4![]() 10-11
10-11
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
回答下列问题:
(1)再生酸中主要含有硝酸,采取减压蒸馏的原因是_______________________
(2)渣1的主要成份为______(填化学式)
(3)转化时发生反应的离子方程式______________________________
(4)用平衡移动的原理解释沉镍的原理_____________________________
(5)渣3的主要成分为氢氧化钙和_______________ 、_________________(填化学式)
(6)国家排放标准要求c(F-)≤3.8 mgL-1。残液中残留的Ca2+浓度至少应为_____mgL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室欲配制80 g质量分数为10%的氢氧化钠溶液,如图是配制该氢氧化钠溶液的实验操作示意图。回答下列问题:

(1)计算:需要氢氧化钠固体___g,水____mL(水的密度以1.0g/cm3计)。
(2)称量:用托盘天平称取氢氧化钠固体,用规格为____(填“10mL”、“50mL”或“100mL”)的量筒取所需要的水,倒入盛有氢氧化钠的烧杯中。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅、锗(32Ge,熔点 937℃)和镓(31Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
(1)硅在元素周期表中的位置是________。
(2)硅和锗与氯元素都能形成氯化物 RCl4(R代表Si和Ge),从原子结构角度解释原因 _______。
(3)自然界矿石中锗浓度非常低,因此从锗加工废料(含游离态锗)中回收锗是一种非常重要的方法。如图是一种提取锗的流程:
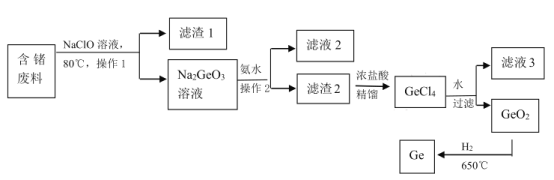
①NaClO 溶液浸取含锗废料中的锗时发生反应的离子方程式为_____;为了加NaClO 溶液浸取含锗废料的速率,可以采取的措施有_____。
②操作 1 和操作 2 是____。
③ GeO2 的熔点为 1086℃,利用氢气还原GeO2,每生成 146kg 的锗放出 akJ 的热量,该反应的热化学方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】香豆素-3-羧酸![]() 是一种重要的香料,常用作日常用品或食品的加香剂。
是一种重要的香料,常用作日常用品或食品的加香剂。
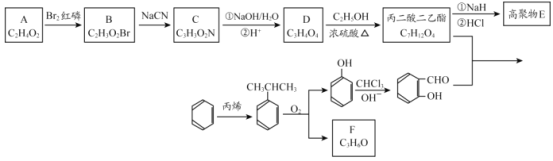
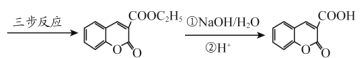
已知:
RCOOR′+ R″OH ![]() RCOOR″ + R′OH(R 代表烃基)
RCOOR″ + R′OH(R 代表烃基)

(1)A和B均有酸性,A 的结构简式__________;苯与丙烯反应的类型是_______。
(2)F 为链状结构,且一氯代物只有一种,则F 含有的官能团名称为__________。
(3)D→丙二酸二乙酯的化学方程式:_______。
(4)丙二酸二乙酯在一定条件下可形成聚合物 E,其结构简式为:________。
(5)写出符合下列条件的丙二酸二乙酯同分异构体的结构简式:________。
①与丙二酸二乙酯的官能团相同;
②核磁共振氢谱有三个吸收峰,且峰面积之比为 3:2:1;
③能发生银镜反应。
(6)丙二酸二乙酯与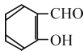 经过三步反应合成
经过三步反应合成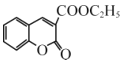 。
。
请写出中间产物的结构简式。

中间产物I__________;中间产物II___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)、 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
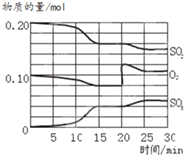
(1)降低温度,SO2的转化率_________,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(二) 在一个固定体积的密闭容器中,充入 2 mol A 和1 mol B,发生如下反应:2 A(g) + B(g)![]() 3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为_____反应(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是____________(用序号填空)
① 4 mol A + 2 mol B ② 3 mol C + 1 mol D + 1 mol B
③ 3 mol C + 2 mol D ④ 1.6 mol A + 0.8 mol B + 0.6 mol C
查看答案和解析>>
科目: 来源: 题型:
【题目】有人设计了如图所示实验装置,目的是做钠与水反应实验,并验证①钠的物理性质;②钠与水反应的产物是什么。

(1)当进行适当操作时还需要的仪器有________。
(2)如何进行操作?__________。
(3)实验现象是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com