
科目: 来源: 题型:
【题目】锂离子电池正极材料需要纯度较高的硫酸锰,目前工业硫酸锰中杂质(钙、镁、铁等)含量高,利用下图流程可制取纯度较高的硫酸锰溶液。
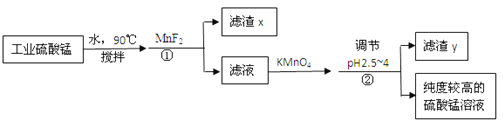
反应①使杂质生成氟化物的沉淀,对反应①前后的杂质含量检测结果(以350g/LMnSO4计)如下:
杂质 | 净化前/g | 净化后/g | 去除率/% |
Fe2+、Fe3+ | 0.001275 | 0.001275 | ﹣ |
Ca2+ | 0.490000 | 0.021510 | 95.61 |
Mg2+ | 0.252000 | 0.025100 | 90.04 |
(1)滤渣x中含有的物质是_____。
(2)试分析钙镁去除结果不同的原因:_____。
(3)在滤液中加入KMnO4可以将Fe2+氧化为Fe3+,同时生成Mn2+.该反应的离子方程式为_____。
(4)已知:生成氢氧化物沉淀的pH
Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 6.3 | 1.5 | 8.3 |
完全沉淀时 | 8.3 | 2.8 | 9.8 |
注:金属离子的起始浓度为0.1mol/L
根据表中数据解释流程中②的目的:_____。
(5)进一步研究表明,如果反应①后不过滤直接加入KMnO4,同时控制加入的量,反应后调节pH,然后再过滤,可以进一步提高钙镁的去除率.钙镁去除率提高的原因有如下假设:
假设I:Fe2+与生成了Fe3+,Fe3+水解生成的Fe(OH)3吸附了沉淀物;
假设II:Mn2+与反应生成的活性MnO2吸附了沉淀物。
选择适当的无机试剂,设计实验验证假设是否成立____________________。
(6)锂离子电池充放电过程中,锂离子在正极和负极之间来回移动,就像一把摇椅,称“摇椅式电池”。典型的锂离子电池工作原理如图所示。
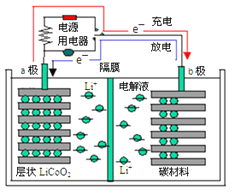
①放电时Li+的移动方向从__________极到极_____(填“a”或“b”)。
②已知电极总反应:LiCoO2+C![]() Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在1L0.1mol·L-1的NaHCO3溶液中,下列关系式正确
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
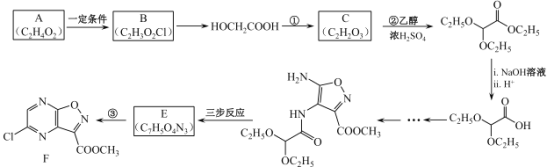
【题目】法匹拉韦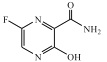 是我国最早批准的可用于抗新冠肺炎临床试验的药物之一,而最新文献研究也证实了其对新型冠状病毒(2019-nCoV)表现出良好的体外抑制作用。F是合成法匹拉韦过程中的重要中间体,其合成路线如图:
是我国最早批准的可用于抗新冠肺炎临床试验的药物之一,而最新文献研究也证实了其对新型冠状病毒(2019-nCoV)表现出良好的体外抑制作用。F是合成法匹拉韦过程中的重要中间体,其合成路线如图:
已知:
i.R-CHO![]()
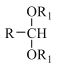
ii.R-NH2 +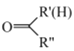
![]()
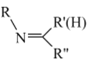 + H2O
+ H2O
(1)法匹拉韦包含的含氧官能团是 __________。
(2)A可以与Na2CO3反应产生CO2,B与NaOH反应的方程式是_______。
(3)反应①的反应物和条件是 __________。
(4)合成E分三步进行,③为取代反应,中间产物2和E互为同分异构体,请写出中间产物2和E的结构简式。
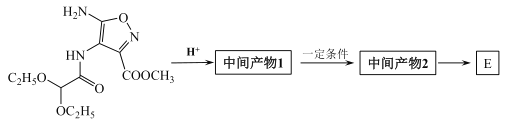
中间产物2___________E____________
(5)依据中间产物1的生成,判断反应②的目的是_________。
(6)在上述三步反应中,第二步反应除了生成中间产物2,还有另一个含有两个五元环的副产物,该副产物的结构简式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.2-甲基丁烷也称异丁烷
B.C4H9Cl有3种同分异构体
C.正丁烷的4个碳原子可以在同一直线上
D.甲烷、乙烷、丙烷的结构都只有一种
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学小组同学研究 Cu与H2SO4 溶液反应,小伟同学实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ | 取螺旋状铜丝在酒精灯上烧至红热,迅速伸入装有 10 mL 3 mol/L H2SO4溶液的试管中 | 产生大量白雾;溶液颜色变为浅蓝色;试管中出现红色浑浊 |
Ⅱ | 步骤一:取螺旋状铜丝在酒精灯上烧至红热, 迅速伸入装有10 mL蒸馏水的试管中; 步骤二:冷却后加入5 mL 3 mol/L H2SO4 | 步骤一:产生少量白雾;试管中出现黑色浑浊,略带红色 步骤二:浑浊全部为红色;溶液略显蓝色 |
(1)实验一:探究白雾的成分
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式 ________。
②艳艳同学认为不妥,补充实验Ⅲ:
实验编号 | 实验操作 | 实验现象 |
Ⅲ | 步骤一:取品红溶液,加 3 mol/L H2SO4溶液,加热; 步骤二:收集实验Ⅰ中白雾,加入品红溶液,加热 | 步骤一:溶液褪色,加热无颜色变化; 步骤二:溶液褪色,加热无颜色变化 |
根据实验Ⅲ,可推断白雾成分是______,而并非SO2。
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
(资料)Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式 _______。
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,__________。
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了______。
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
实验编号 | 实验操作 | 实验现象 |
Ⅳ | 取Cu2O固体少量,加入到装有 10 mL3 mol/L H2SO4 溶液的试管中 | 溶液迅速变为蓝色;试管中出现少量亮红色固体 |
Ⅴ | 取Cu2O固体少量,加入到装有 10 mL 3 mol/L H2SO4 和少量CuSO4 (浅蓝色)的试管中 | 现象同Ⅳ |
Ⅵ | 重复实验Ⅰ,振荡试管,分为两等份。第一份立刻加入浓硫酸至 c(H2SO4)=3 mol/L;第二份静置 4 h之后,过滤,向固体中加入浓硫酸至 c(H2SO4)=3 mol/L | 第一份加酸后红色固体明显减少,溶液蓝色加深;第二份静置时,固体减少,溶液缓慢变为蓝色,固体加酸后无明显现象。 |
①实验Ⅴ的目的是 ______。
②通过以上实验,臧臧同学得出的结论是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。
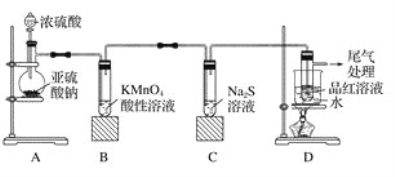
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的 KCl 饱和溶液)

A.正极反应为 Zn- 2e- == Zn2+
B.取出盐桥后,检流计依然发生偏转
C.反应中,盐桥中的 K+会移向 CuSO4 溶液
D.电子从负极流向正极,再经盐桥流回负极
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化法冶金过程中产生大量的含氰废水(主要包括CN-、Cu(CN)32-、SO32-等离子),可以通过沉淀——电解氧化法进行处理,某小组同学对该过程进行模拟。
资料1:溶液中存在平衡Cu(CN)32-![]() CuCN↓+2CN-
CuCN↓+2CN-
资料2:2Cu2++4CN-=2CuCN ↓+(CN)2
(1)利用CuCl2溶液对含氰废水进行初步沉淀处理。溶液中总氰(CNT)、游离氰(CN-)的去除率随CuCl2加入量变化趋势如图所示。

CuCl2加入量对总氰(CNT)、游离氰(CN-)去除率的影响
①请用平衡移动原理解释,随着CuCl2加入量增大(3.0 g以前),溶液中总氰(CNT)、游离氰(CN-)的去除率变化趋势_________。
②在SO32-的作用下,CuCl2可将废水中的Cu(CN)32-直接转化为CuCN沉淀,该过程的离子方程式为__________。
(2)利用钛电极对沉淀后的废液中残留的CN-等离子进一步进行电解处理,在一定的电压下,在阳极观察到明显的气泡,经检验,其主要成分为N2和CO2。该小组同学实验时发现,若将(1)中沉淀剂CuCl2换为CuSO4,电解法几乎不能去除CN-。
①下列关于电解氧化法处理废水的说法正确的是__________。
A.阳极处观察到的气泡主要是由于 CN-在阳极放电产生的
B.电解结束之后,该小组同学在阴极处能回收金属铜
C.电解法处理过程中,Cu(CN)32-向阳极迁移
②CN-中包含碳氮三键,该离子中碳元素的化合价为 ______。
③请用化学用语解释电解过程中Cl-的作用:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产的纯碱常含有少量的NaCl等杂质。如图是测定产品中Na2CO3质量分数的实验装置。操作步骤如下:
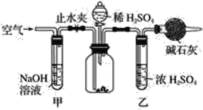
A.在干燥管内填满碱石灰,质量为mg
B.取ng样品装入广口瓶中
C.检查装置气密性
D.关闭止水夹
E.打开止水夹
F.缓慢鼓入空气数分钟,再称干燥管质量为Wg
G.缓慢加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
(1)正确的操作顺序是______________________________________。
(2)步骤F中,要缓缓鼓入空气数分钟,鼓入空气的目的是________________,装置甲的作用是______________________________,装置乙的作用是___________________________。
(3)计算样品中Na2CO3的质量分数的计算式是______________。
(4)若去掉装置甲,测定结果会______________;若去掉装置乙,测定结果会__________。(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com