
科目: 来源: 题型:
【题目】完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①![]() O、
O、![]() O、
O、![]() O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥
O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥![]() K、
K、![]() Ca、
Ca、![]() Ar,回答下列问题:
Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)![]() H2
H2![]() O的摩尔质量为____________,相同质量的
O的摩尔质量为____________,相同质量的![]() H2
H2![]() O与
O与![]() H2
H2![]() O所含质子数之比为______,中子数之比为__________。
O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的![]() H2
H2![]() O和
O和![]() H2
H2![]() O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(1)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=
CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=![]() ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
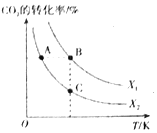
①X1___X2(填“>”或“<”,后同),Q___0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为___。
(2)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO![]() ):c(HCO
):c(HCO![]() )=___[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
)=___[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为___。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6].(忽略溶液体积积的变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)纯水在100 ℃时,pH=6,该温度下0.1mol·L-1的NaOH溶液中,pH= _____,由水电离出的c(OH-)= ___mol·L-1。
(2)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是________(填字母)。(①表示盐酸,②表示醋酸)

(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
已知:25 ℃时,等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三种溶液的pH由大到小的顺序为____________
(4)常温时,pH=4的盐酸和pH=9的氢氧化钠溶液混合,若所得混合溶液的pH=7,则盐酸和氢氧化钠溶液的体积比为_______。
Ⅱ.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 15.12 | 20.00 |
2 | 0.1000 | 14.98 | 20.00 |
3 | 0.1000 | 14.90 | 20.00 |
(1)配制10mL 0 .1000mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①滴定达到终点的现象是______________________。
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字),
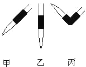
③排去碱式滴定管中气泡方法如图所示,应采用操作____________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)分别对测定结果造成什么影响?(填“偏低”、“偏高”、“无影响”)
A.滴定终点读数时俯视读数___________。
B.碱式滴定管尖嘴部分有气泡,滴定后消失_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示。请依图回答下列问题:
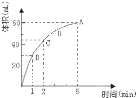
(1)放出一半气体所需要的时间为______;
(2)A、B、C、D各点反应速率快慢的顺序是________;
(3)过氧化氢溶液的初始物质的量浓度为________。(保留2位小数)
Ⅱ.汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0,已知该反应在2404 ℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404 ℃时,平衡常数K=64×10-4。
(1)某温度下,向2 L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,N2的反应速率为_________, 此时N2 的转化率______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志_____(填字母序号)。
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
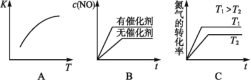
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,图变化趋势正确的是________(填字母序号)。
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应v正 _____v逆。
(5)某生提出,下列方法可以冶炼钢铁:FeO(s)+C(s)=Fe(s)+CO(g) ΔH>0,ΔS>0,上述反应在_____(低温或高温)条件下能自发进行。
(6)现有反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH>0,如图表示反应Ⅱ在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是_______。

A.升高温度
B.降低温度
C.加入催化剂
D.增大压强
E.减小压强
F.充入CO2
G.分离出部分CO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质之间有如下反应关系:

已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断错误的是( )
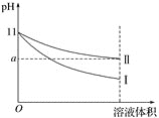
A. a值一定大于9
B. Ⅰ为NaOH溶液稀释时溶液的pH变化曲线
C. 完全中和稀释相同倍数后的两溶液,消耗相同浓度的稀H2SO4的体积V(NaOH)<V(氨水)
D. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是

A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质
B.NH3、CO2的水溶液能导电,所以NH3、CO2是电解质
C.铜、石墨均能导电,所以它们都是电解质
D.蔗糖在水溶液中或熔融时均不导电,所以是非电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷烃,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
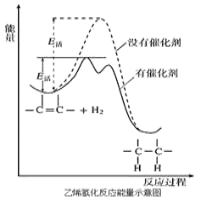
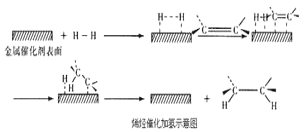
下列说法中正确的是( )
A.乙烯和H2生成乙烷的反应是放热反应
B.加入催化剂,可减小反应的热效应
C.催化剂能改变平衡转化率,不能改变化学平衡常数
D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com