
科目: 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的,请回答:
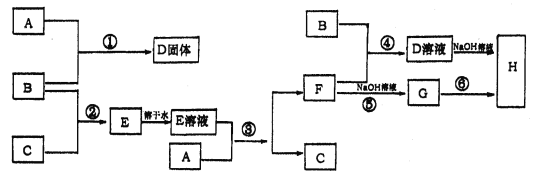
(1)A是_____________,B是______________,C是___________(填化学式)
(2)反应⑥的化学方程式为:__________________________________________。
(3)反应④的离子方程式为:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示,下列有关叙述不正确的是

A. X的分子式为C8H8O2
B. X、Y、Z均能和NaOH溶液反应
C. 可用NaHCO3溶液鉴别Y和Z
D. 1mol X跟足量H2反应,最多消耗4mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列叙述正确的是____________________
A.含有共价键的化合物一定是共价化合物
B.现已发现的零族元素的单质在常温常压下都是气体
C.第ⅥA族元素的原子,其半径越大,越容易得到电子
D.第n主族元素其最高价氧化物分子式为R2On,氢化物分子式为RHn (n≥4)
E.所有主族元素最高正化合价等于最外层电子数
F.稀有气体原子与同周期I A、ⅡA族元素的简单阳离子具有相同的核外电子排布
G.共价化合物中不可能含有离子键
H.只有非金属原子间才能形成共价键
I.非金属原子间不可能形成离子化合物
(2)写出下列物质的电子式
MgBr2 ___________________ CCl4_______________HClO_______________
N2 ___________________ NH4Cl_______________NH3_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】氟气与水反应的化学方程式_______________________________________
铁与水蒸气反应的化学方程式______________________________________
n(FeBr2): n(Cl2)=1:1反应的离子方程式_______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在三个密闭容器中分别充入Ne、H2、O2三种气体,在以下各种情况下排序正确的是( )
A.当它们的体积、温度和压强均相同时,三种气体的密度ρ(H2)>ρ(Ne)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强p(H2)>p(Ne)>p(O2)
C.当它们的质量、温度和压强均相同时,三种气体的体积V(O2)>V(Ne)>V(H2)
D.当它们的压强、体积和温度均相同时,三种气体的质量m(H2)>m(Ne)>m(O2)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
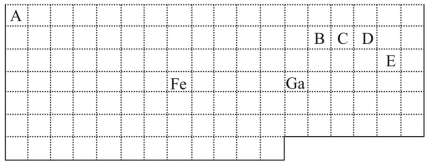
根据信息回答下列问题:
(1)周期表中基态Ga原子的电子排布式为___。
(2)Fe元素位于周期表的___分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为___。
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为___和___(填化学式)。在CO、CH3OH中,碳原子采取sp3杂化的分子有___。
(4)根据VSEPR理论预测ED4-离子的空间构型为___。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有__(任写2种化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。

(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是主要的温室气体,也是一种工业原料。回收利用CO2有利于缓解温室效应带来的环境问题。
(1)我国科学家通过采用一种新型复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。
已知:2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol
2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol

25℃、101kPa条件下,CO2与H2反应生成辛烷(以C8H18表示)和液态水的热化学方程式是_________。
(2)CO2催化加氢合成乙醇的反应原理是:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=![]() 。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
(3)在Cu/ZnO催化剂存在下,将CO2与H2混合可合成甲醇,同时发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
反应Ⅱ CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
实验序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
实验1 | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
实验2 | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
实验3 | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
实验4 | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比实验1和实验3可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
②对比实验1和实验 2可发现:在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有_______。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大![]() 的初始投料比
的初始投料比
(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2,电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是_____________。
②工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下______L 的CO2。
查看答案和解析>>
科目: 来源: 题型:
【题目】Q、R、X、Y、Z为短周期主族元素,且原子序数依次递增。Q的低价氧化物与R单质分子的电子总数相等,X与Q同族,Y和Z的离子与Ar原子的电子结构相同。
(1)Q的最高价氧化物中Q的杂化类型为___,分子中含有___个σ键,___个π键。
(2)X的氢化物分子的立体构型是___,属于__分子(填“极性”或“非极性”);它与R形成的化合物可作为一种重要的陶瓷材料,其化学式是___。
(3)Q分别与Y、Z形成的共价化合物的化学式是___和___;Q与Y形成的分子的电子式是__,属于___分子(填“极性”或“非极性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com