
科目: 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出一点即可)。_________
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
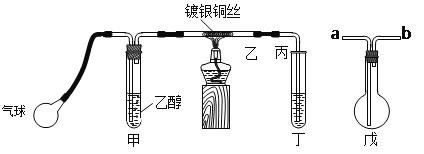
(1)甲装置常常浸在70~80℃的水浴中,目的是__________________________________。
(2)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_______、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在____________中。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示的实验,回答问题:
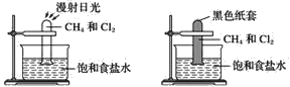
(1)装置A中的实验现象是____________________装置B中的实验现象是____
(2)根据上述实验,你能得出的结论是________________________________
(3)写出上述实验A中反应的化学方程式:
____________________________________________________;
____________________________________________________;
___________________________________________________;
______________________________________________________。
(4)上述反应的反应类型是________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下图所示的装置制取少量溴苯。
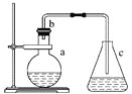
请回答下列问题:
(1)在烧瓶a中反应的化学方程式是__________________________________________。
(2)与烧瓶口垂直的一段长导管的作用是______________________________________。
(3)锥形瓶C中盛放四氯化碳的作用是________________________________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向锥形瓶C中加入硝酸银溶液,若________,则能证明。另一种验证的方法是向锥形瓶C中加入________________________,现象是________________________________________________________________________。
(5)生成的溴苯因溶有未反应的溴而显褐色,提纯的方法是____________________________。
(6)实验结束时,将氢氧化钠溶液倒入烧瓶中,充分振荡,目的是_________________________,反应的化学方程式是_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】R、X、Y、Z的原子序数依次增大,且都不超过10.这四种元素可组成一种化合物的结构如图所示。下列说法正确的是( )
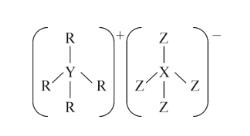
A.常温常压下,上述元素的单质都呈气态
B.最高价氧化物对应水化物的酸性:X>Y
C.Y、Z的气态氢化物能发生化合反应
D.由R、X两种元素只能形成一种化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】根据乙酸的性质回答下列问题:
(1)将醋酸钠晶体与浓硫酸共热,可观察到的现象为___________;反应的化学方程式为________。
(2)在滴有酚酞的氢氧化钠溶液中,逐滴加乙酸至过量,现象为_______;反应的离子方程式为_______。
(3)在碳酸钠溶液中,加入乙酸后,有________放出,反应的离子方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学给分子式为C12H26的某烷烃命名为“2,4-二甲基-3,5-二乙基己烷”,另一同学认为这样命名有错误,有关该烷烃的说法,你认为正确的是
A. 若该烷烃由单烯烃与氢气加成而得,则原单烯烃可有11种不同结构
B. 该烷烃的一氯代物有10种
C. 该烷烃正确名称应为2,4,5-三甲基-3-乙基庚烷
D. 该烷烃分子中含有5个支链
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com