
科目: 来源: 题型:
【题目】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成![]() ,同时还有___________离子被氧化。写出VO+转化为
,同时还有___________离子被氧化。写出VO+转化为![]() 反应的离子方程式___________。
反应的离子方程式___________。
(3)“中和沉淀”中,钒水解并沉淀为![]() ,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
(4)“沉淀转溶”中,![]() 转化为钒酸盐溶解。滤渣③的主要成分是___________。
转化为钒酸盐溶解。滤渣③的主要成分是___________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。

(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1.2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g/cm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请按要求回答下列问题:
(1)写出A装置中的化学反应方程式_____;
(2)装置C中盛有氢氧化钠溶液,其作用是_____
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____
(4)判断该制备反应已经结束的最简单方法是_____;
(5)若产物中有少量未反应的Br2,最好用_____洗涤除去;(填正确选项前的字母)
a 水 b 亚硫酸氢钠 c 碘化钠溶液 d 乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是_____;但又不能过度冷却(如用冰水),其原因是_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种优良的消毒剂,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,实验室在50℃时制备ClO2。
实验Ⅰ:制取并收集ClO2,装置如图所示:
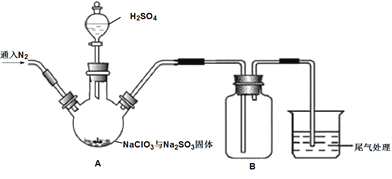
(1)写出用上述装置制取ClO2的化学反应方程式_____________。
(2)装置A中持续通入N2的目的是___________。装置B应添加__________(填“冰水浴”、“沸水浴”或“50℃的热水浴”)装置。
实验Ⅱ:测定装置A中ClO2的质量,设计装置如图:
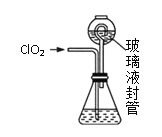
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I+S4O62-)。
(3)装置中玻璃液封管的作用是_____________。
(4)滴定终点的现象是___________________。
(5)测得通入ClO2的质量m(ClO2)=_______g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。


(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是 ______________________。
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色。为测定该实验所得 “铁块”中铁元素含量,设计实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择________,试剂B应选择_______。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式_____________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4。
操作 | 预期现象 |
取少量M固体于试管中,向其中加入________________;观察。 | 固体完全溶解,溶液呈黄色。 |
继续向上述溶液中滴入_________________,振荡观察 | ______________________ |
④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是____________。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
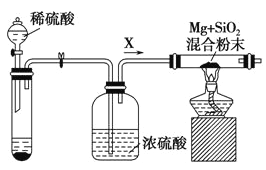
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:
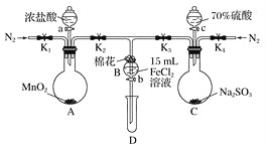
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________。
(2)棉花中浸润的溶液为__________________。作用是_______________________。
(3)A中发生反应的化学方程式:______________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________。用______________(写试剂化学式)检验氧化产物,现象是___________________________。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________(填“甲”“乙”或“丙”)。

查看答案和解析>>
科目: 来源: 题型:
【题目】均三甲苯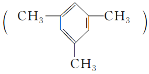 是一种易燃、不溶于水、比水密度小的有毒液体,是重要的有机化工原料,用于制备合成树脂、抗氧化剂等。
是一种易燃、不溶于水、比水密度小的有毒液体,是重要的有机化工原料,用于制备合成树脂、抗氧化剂等。
(1)均三甲苯属于苯的同系物,选用一种试剂区别苯和均三甲苯:________________。
(2)均三甲苯分子中的一个H原子被Cl原子取代,所得产物有________种。
(3)下列属于苯的同系物的是________(填字母)。
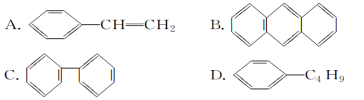
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是________(填字母)。
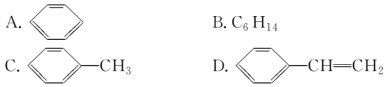
查看答案和解析>>
科目: 来源: 题型:
【题目】现有以下几种有机物:
①![]() ②
②![]() ③
③ ④
④![]() ⑤
⑤![]()
⑥![]() ⑦
⑦ ⑧
⑧![]() ⑨
⑨![]()
请利用上述给出的物质按要求回答下列问题:
(1)③的系统命名是________。
(2)用“>”表示①③④⑧熔沸点高低顺序:________(填序号)。
(3)与③互为同系物的是________(填序号)。
(4)⑨的一氯代物同分异构体数目有________种。
(5)在120℃,![]() 条件下,某种气态烃与足量的
条件下,某种气态烃与足量的![]() 完全反应后,测得反应前后气体的体积没有发生改变,则该烃是________(填序号)。
完全反应后,测得反应前后气体的体积没有发生改变,则该烃是________(填序号)。
(6)写出⑥在铁作催化剂的条件下与液溴发生取代反应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
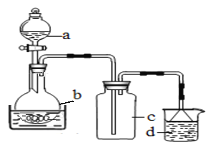
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________、___________,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________。
②用5mL __________溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:

i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________。
⑤步骤ii后期反应的离子方程式是__________。
(3)由以上探究硝酸铁的性质实验得出的结论是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com