
科目: 来源: 题型:
【题目】电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是
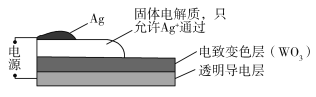
A.Ag为阳极B.Ag+由银电极向变色层迁移
C.W元素的化合价升高D.总反应为:WO3+xAg=AgxWO3
查看答案和解析>>
科目: 来源: 题型:
【题目】探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论正确的是
A.新制饱和氯水使红玫瑰变力白玫瑰,说明含有Cl2
B.加入石蕊溶液,溶液变红,说明该溶液不含HC1O
C.光照新制氯水有气泡逸出,该气体是氧气
D.向氯水中KHCO3粉末有气泡产生,说明绿水中含有HC1O
查看答案和解析>>
科目: 来源: 题型:
【题目】据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是
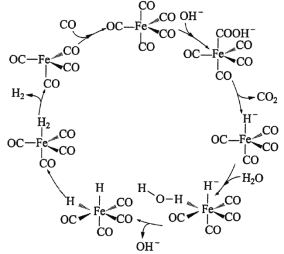
A.OH-参与了该催化循环B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2D.该催化循环中Fe的成键数目发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是

A.海水酸化能引起![]() 浓度增大、
浓度增大、![]() 浓度减小
浓度减小
B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C.CO2能引起海水酸化,其原理为![]()
![]() H++
H++![]()
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
查看答案和解析>>
科目: 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 46 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为 ( )
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A.+412 kJ·mol-1B.-412 kJ·mol-1
C.+236 kJ·mol-1D.-236 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】有机碱,例如二甲基胺(![]() )、苯胺(
)、苯胺(![]() ),吡啶(
),吡啶(![]() )等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:

已知如下信息:
①H2C=CH2![]()
![]()
②![]() +RNH2
+RNH2![]()
![]()
③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为________。
(2)由B生成C的化学方程式为________。
(3)C中所含官能团的名称为________。
(4)由C生成D的反应类型为________。
(5)D的结构简式为________。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6∶2∶2∶1的有________种,其中,芳香环上为二取代的结构简式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
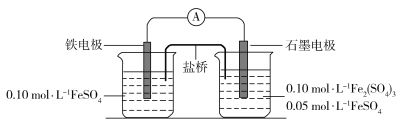
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_________(从下列图中选择,写出名称)。

(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择____________作为电解质。
阳离子 | u∞×108/(m2·s1·V1) | 阴离子 | u∞×108/(m2·s1·V1) |
Li+ | 4.07 |
| 4.61 |
Na+ | 5.19 |
| 7.40 |
Ca2+ | 6.59 | Cl | 7.91 |
K+ | 7.62 |
| 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了Fe2+氧化性小于________,还原性小于________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_________。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是_________。I1(Be)> I1(B)> I1(Li),原因是________。
(3)磷酸根离子的空间构型为_______,其中P的价层电子对数为_______、杂化轨道类型为_______。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
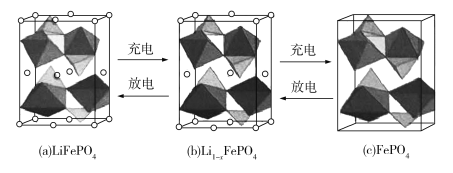
电池充电时,LiFeO4脱出部分Li+,形成Li1xFePO4,结构示意图如(b)所示,则x=_______,n(Fe2+ )∶n(Fe3+)=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=98 kJ·mol1。回答下列问题:
SO3(g) ΔH=98 kJ·mol1。回答下列问题:
(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_________。

(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α 随温度的变化如图所示。反应在5.0MPa、550℃时的α=__________,判断的依据是__________。影响α的因素有__________。

(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO2催化氧化的反应速率方程为:v=k(![]() 1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
1)0.8(1nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。

曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com