
科目: 来源: 题型:
【题目】下列有关说法正确的是
A.常温下,![]() 溶液的
溶液的![]()
B.工业上电解饱和食盐水时,以石墨为阴极,铁棒为阳极
C.铅蓄电池放电时,正极电极反应为:![]()
D.常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,![]() 减小,
减小,![]() 减小
减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知![]() 可用
可用![]() 来检验呈蓝色
来检验呈蓝色![]() 将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有
将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有![]() 及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图)II示发生了变化.则下列说法正确的是
及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图)II示发生了变化.则下列说法正确的是
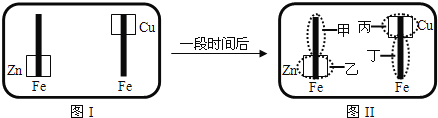
A.甲区不变色B.乙区呈现蓝色
C.丙区产生![]() 离子D.丁区产生
离子D.丁区产生![]() 离子
离子
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬![]() 在溶液中主要以
在溶液中主要以![]() 蓝紫色
蓝紫色![]() 、
、![]() 绿色
绿色![]() 、
、![]() 橙红色
橙红色![]() 、
、![]() 黄色
黄色![]() 等形式存在,
等形式存在,![]() 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)![]() 与
与![]() 的化学性质相似,在
的化学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
(2)![]() 和
和![]() 在溶液中可相互转化
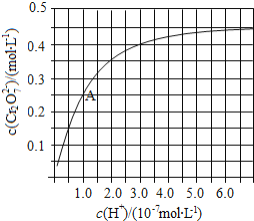
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示.
的变化如图所示.
![]() 用离子方程式表示
用离子方程式表示![]() 溶液中的转化反应______________________________ .
溶液中的转化反应______________________________ .
![]() 由图可知,溶液酸性增大,
由图可知,溶液酸性增大,![]() 的平衡转化率__________________
的平衡转化率__________________ ![]() 填“增大“减 小”或“不变”
填“增大“减 小”或“不变”![]() 根据A点数据,计算出该转化反应的平衡常数为 _______________ .
根据A点数据,计算出该转化反应的平衡常数为 _______________ .
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的![]() ______
______ ![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为 ______
为 ______ ![]() ,此时溶液中
,此时溶液中![]() 等于 ______
等于 ______ ![]() 已知
已知![]() 、AgCl的
、AgCl的![]() 分别为
分别为![]() 和
和![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为 _________________________________________________ .
,反应的离子方程式为 _________________________________________________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.摩尔是物质的量的单位,1mol任何物质都含有6.02×1023个分子
B.钠元素和氯元素在自然界存在的形态既有游离态又有化合态
C.气体的体积主要由气体物质的量的多少和气体分子间的平均距离决定的
D.若1克水中含有m个氢原子,则阿伏加德罗常数用含m的代数式可表示为18m
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
C | 2NO2(g) | 加压平衡向着气体颜色加深的方向移动 |
D | 将MgCl2溶液蒸干后灼烧,得到MgO固体 | 蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
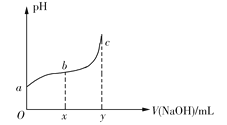
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
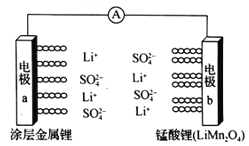
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目: 来源: 题型:
【题目】在300mL的密闭固定容器中,一定条件下发生Ni(s)+4CO(g) ![]() Ni(CO)4(g)的反应,该反应平衡常数(K)与温度(T)的关系如下表所示:
Ni(CO)4(g)的反应,该反应平衡常数(K)与温度(T)的关系如下表所示:
T/℃ | 25 | 80 | 230 |
K | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )。
A.上述生成Ni(CO)4(g)的反应为放热反应
B.230℃时,该反应的正反应为不自发的反应
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol·L-1
D.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
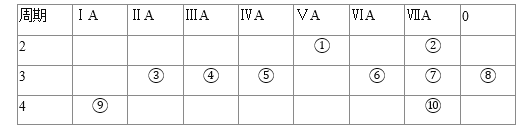
(1)①和⑤的元素符号是 ______ 和 ______ .
(2)表中最活泼的金属是 ______ ,非金属性最强的元素是 ______ ![]() 填写元素符号
填写元素符号![]()
(3)表中能形成两性氢氧化物的元素是 ______ ![]() 填写元素符号
填写元素符号![]() ,分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式: ______ , ______ .
,分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式: ______ , ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
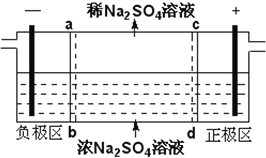
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com