
科目: 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 |
|
| HClO |
|
|
电离平衡常数 |
|
|
|
|
|
(1)25℃时,等浓度的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,3种溶液的pH由大到小的顺序为________。
溶液,3种溶液的pH由大到小的顺序为________。
(2)工业上可用氨水除去尾气![]() 。将
。将![]() 通入氨水中,当
通入氨水中,当![]() 降至
降至![]() _____。
_____。
(3)常温下,用![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲线如图:
溶液所得滴定曲线如图:
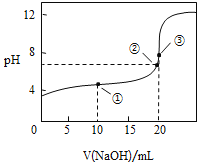
①在整个实验过程中,不需要的仪器或用品是 ______(填序号).
![]() 容量瓶 b 锥形瓶c 滴定管夹d 漏斗e 玻璃棒f 滴定管
容量瓶 b 锥形瓶c 滴定管夹d 漏斗e 玻璃棒f 滴定管
②到达滴定终点的标志是 _____________ .
③下列操作会导致测定结果偏高的是 ______ .
A 碱式滴定管在装液前未用标准NaOH溶液润洗
B 滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C 碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D 达到滴定终点时,仰视读数
④如图点①所示溶液中![]() __________
__________![]() 填“>”“<”或“=”,下同,点②所示溶液中:
填“>”“<”或“=”,下同,点②所示溶液中:![]() ________
________![]() ,点③所示溶液中所有离子浓度由大到小的顺序为:_________。
,点③所示溶液中所有离子浓度由大到小的顺序为:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.钠着火可以用水扑灭
B.氯气能与铁反应,所以液氯不宜贮存在钢瓶中
C.漂白粉露置于空气中会变质的反应涉及到氧化还原反应
D.FeCl3既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S 为二元弱酸,20 ℃的 pKa1=6.89,pKa2=14.15(电离常数 K 的负对数-lg K=pK)。在20 ℃时,向 0.1 mol·L1 的 Na2S 溶液中缓慢通入 HCl(忽略溶液体积变化和 H2S 的挥发),在该过程中下列微粒物质的量浓度关系一定正确的是
A.溶液中 c(HS-)=c(S2-)时,c(S2-)+2c(H2S)<c(Cl-)
B.溶液呈中性时,c(HS- )+c(H2S)=c(Cl- )
C.溶液 pH=6.89 时,c(Cl- )>c(HS- )=c(H2S)>c(H+)>c(OH-)
D.溶液中 c(Cl-)=0.2 mol·L-1 时,c(OH-)+c(HS- )+c(S2-)=c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A.制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO ![]() Mg
Mg
B.冶炼铝:铝土矿![]() NaAlO2
NaAlO2 ![]() 无水 AlCl3
无水 AlCl3![]() Al
Al
C.制硝酸: N2、H2![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3![]() 浓 HNO3
浓 HNO3
D.海带![]() 海带灰
海带灰![]() I2(aq)
I2(aq) ![]() I2
I2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.1871 年门捷列夫最早预言了类硅元素锗,1886 年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:
1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;
2.GeCl4易水解,在浓盐酸中溶解度低。
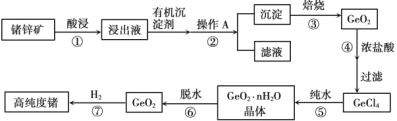
(1)锗元素在周期表中的位置:_____。
(2)步骤②操作A方法是_____。
(3)步骤③中的物质在_____(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是_____。
(5)写出步骤⑦的化学方程式_____。
Ⅱ.将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4·H2O。
(1)Cu2+基态核外电子排布式为 _________;1mol [Cu(NH3)4]2+中![]() 键的数目为_______。
键的数目为_______。
(2)SO42-的S原子轨道杂化类型_______________。
(3)NH3极易溶于H2O中,原因为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】药物瑞德西韦(Remdesivir))对2019年新型冠状病毒(2019-nCoV)有明显抑制作用;K为药物合成的中间体,其合成路线如下:
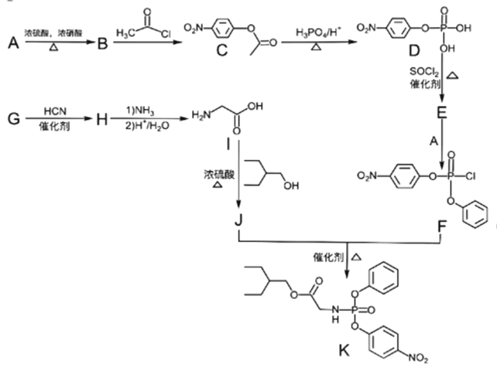
已知:1. ![]()
2. ![]()
回答下列问题:
(1)检验A中官能团的方法是________________,B的化学名称为_________。
(2)C→D的反应类型是_____________,J+F→K的反应类型是___________。
(3)I中官能团的名称为___________________,F的分子式是_____________。
(4)E的结构简式为_________________________________。
(5)由G生成H的化学反应方程式为______________________________________。
(6)X是C同分异构体,写出满足下列条件的X的结构简式__________________。
①苯环上含有硝基且苯环上只有一种氢原子;
②遇FeCl3溶液发生显色反应;
③1mol的X与足量金属Na反应可生成2gH2 。
(7)设计由苯甲醇为原料制备化合物 。
。
___________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
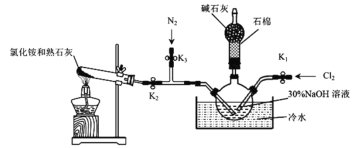
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合理控制、利用燃煤排放的CO2、SO2、CO是优化环境的有效途径。
(1)CO2生产甲醇方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH =a kJ·mol1;
CH3OH(g)+H2O(g) ΔH =a kJ·mol1;
已知:2H2(g)+O2(g)===2H2O(g) ΔH=b kJ·mol1;
H2O(g)===H2O(l) ΔH=c kJ·mol1;
CH3OH(g)===CH3OH(l) ΔH=d kJ·mol1。
则表示CH3OH(l)燃烧热的热化学方程式为_________________________________。
(2)工业生产中用SO2为原料制取硫酸
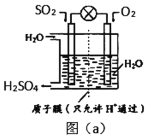
①利用原电池将SO2 转化法,如图(a)所示,则负极的电极反应式为____________。
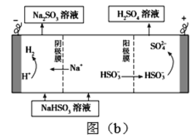
②电解Na2SO3溶液吸收SO2得到的NaHSO3法,如图(b)所示,则阳极反应式______。
(3)光气 (COCl2)是一种重要的化工原料,工业上通过Cl2(g)+CO(g) ![]() COCl2(g)的反应制备。根据图(c)、图(d),回答下列问题:
COCl2(g)的反应制备。根据图(c)、图(d),回答下列问题:
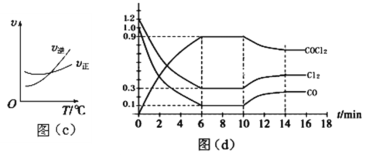
①该反应的正反应是___________ 反应(填“放热”或“吸热”)。
②0~6 min内,反应的平均速率v(Cl2)=_______;该温度下的平衡常数为______。
③若恒温恒容时,在第7 min 向体系中加入这三种物质各2 mol,则平衡_____移动(填“向左”、“向右”或“不”)。
④若恒温恒压时,初始投料浓度为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol·L1、c(COCl2)=______mol·L1,最终达到化学平衡时,Cl2的体积分数与上述第6 min时的相同。
⑤第n min反应温度表示为T(n ),则:T(8)_____T(15) (填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl(用R代表),请根据其组成的元素和结构回答下列问题:
(1)氮原子价层电子的轨道表达式为_____________________。
(2)第一电离能N______O(填“>”、“<”或“=”),其原因是_____________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
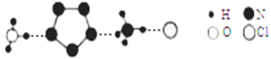
①R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为________个。大π键可用符号πmn表示,其中m为形成大π键的原子数,n为形成大π键的电子数,则N5-中的大π键应表示为__________。
③图中虚线代表氢键,其表示式为(NH4+)NH…Cl、___________、____________。
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:
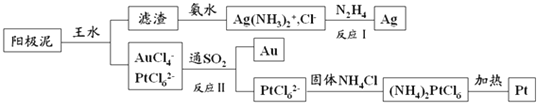
①滤渣的成分是_____________,(NH4)2PtCl6中配体是_______________________。
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是____________________,试写出该反应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:![]()
![]() 下表所列数据是该反应在不同温度下的化学平衡常数
下表所列数据是该反应在不同温度下的化学平衡常数![]() .
.
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”) ![]() 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
(2)已知在常温常压下:
①![]()
②![]()
③![]()
则反应![]() ______
______ ![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______ (已知,
______ (已知,![]() ,
,![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com