
科目: 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O ![]() HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 对2HI(g)![]() H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】国产航母山东舰已经列装服役,它是采用模块制造然后焊接组装而成的,对焊接有着极高的要求。实验室模拟在海水环境和河水环境下对焊接金属材料使用的影响(如图)。下列相关描述中正确的是
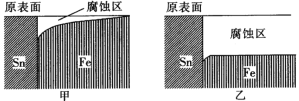
A.由图示的金属腐蚀情况说明了Sn元素的金属性强于Fe元素
B.由图示可以看出甲是海水环境下的腐蚀情况,乙是河水环境下的腐蚀情况
C.两种环境下铁被腐蚀时的电极反应式均为Fe-3e-=Fe3+
D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
查看答案和解析>>
科目: 来源: 题型:
【题目】酸碱中和滴定是中学化学的定量检测手段之一。小豆在学习相关内容后,发现一个问题:能不能检测出家用白醋中醋酸的浓度。于是他设计了以下步骤(假设白醋中只有醋酸能与氢氧化钠反应):
(1)配制100mL1mol/L氢氧化钠标准溶液,此过程中需要的玻璃仪器为___。
(2)将___(填仪器名称)用水洗净并用氢氧化钠标准溶液润洗后,加入氢氧化钠标准溶液至零刻度,固定在滴定管夹上,用___(填仪器名称)准确量取20.00ml白醋置于锥形瓶中,并在锥形瓶中加入适量酚酞溶液。
(3)进行滴定。请写出滴定终点时的现象:___。
(4)多次测定后,平均消耗氢氧化钠的体积为16.00mL,则白醋中醋酸浓度为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示:
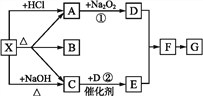
图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
(1)物质X可以是______,C是_________, F是______。
(2)反应①的化学方程式是_________,反应②的化学方程式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】对氨基苯甲酸(![]() )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(![]() )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
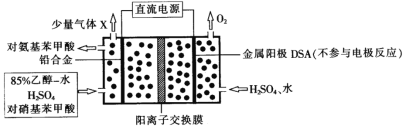
A.电子由金属阳极DSA经导线流入直流电源
B.阴极的主要电极反应式为![]() +6e-+6H+→
+6e-+6H+→![]() +2H2O
+2H2O
C.每转移1mole-时,阳极电解质溶液的质量减少8g
D.反应结束后阳极区pH增大
查看答案和解析>>
科目: 来源: 题型:
【题目】新型冠状病毒来势汹汹,但是它依然可防可控。84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。回答下列问题:
(1)在周期表中与Mn相邻且未成对电子数最多的原子的价电子排布式为:___。
(2)K和O第一电离能I1(K)___I1(O)(填“大于”或“小于”)。原因是___。
(3)浓盐酸为HCl的水溶液,HCl极易溶于水的原因___,HCl和H2O中沸点较高的是___,其原因是___。
(4)KClO3晶体中,阴离子的空间构型为___,Cl的杂化轨道与O的2p轨道形成___键。
(5)金属K晶体为体心立方堆积,K原子半径为rpm,摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则晶体密度为___g﹒cm-3。(列出计算式)
查看答案和解析>>
科目: 来源: 题型:
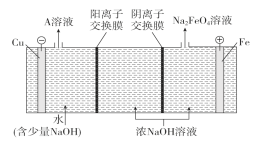
【题目】电化学在化学工业中有着广泛应用。根据图示电化学装置,
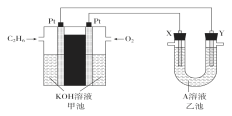
(1)甲池通入乙烷(C2H6)一极的电极反应式为___。
(2)乙池中,若X、Y都是石墨,A是Na2SO4溶液,实验开始时,同时在两极附近溶液中各滴入几滴酚酞溶液,X极的电极反应式为___;一段时间后,在Y极附近观察到的现象是___。
(3)工业上通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,则阳极的电极反应式为__,阴极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼氢化钠(NaBH4)具有强还原性,在工业生产上广泛用于非金属及金属材料的化学镀膜、贵金属回收、工业废水处理等。工业上采用的Bayer法制备NaBH4通常分两步(如图)。下列说法错误的是
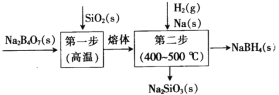
A.用B2O3代替Na2B4O7也可制得NaBH4
B.两步的总反应中氧化剂与还原剂的物质的量之比为2:1
C.将SiO2粉碎能增大得到熔体的速率
D.由图可知该工艺过程中无污染性物质产生,符合绿色化学理念
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作不能达到相应实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向苯与液溴的混合液中加入铁粉,将产生的气体直接通入AgNO3溶液中 | 验证液溴与苯发生取代反应 |
B | 向5mL浓度为0.5mol·L-1的KI溶液中滴加少量氯化铁溶液,再加入少量淀粉溶液,振荡 | 比较I-、Fe2+的还原性强弱 |
C | 向5mL浓度为0.2mol·L-1的MgCl2溶液中滴加少量NaOH溶液,待有白色沉淀生成后,再滴加0.2mol·L-1的CuCl2溶液 | 比较Cu(OH)2、Mg(OH)2溶度积的大小 |
D | 向 | 验证与H+的结合能力: |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com