
科目: 来源: 题型:
【题目】太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜为阳离子交换膜,电池反应式为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )

A.放电时Li+从左边移向右边,PO43-从右边移向左边
B.放电时,正极反应式为Li1-xFePO4+xLi++xe-=LiFePO4
C.充电时M极连接电源的负极,电极反应为6C+xe-=C6x-
D.紧急情况时,电解质可以用Li2SO4饱和溶液代替
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为2∶3的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A.①②③B.①②④C.②③④D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验仪器或装置的选择正确的是
|
|
|
|
配制50.00mL0.1000mol.L-1 Na2CO3溶液 | 除去Cl2中的HCl | 蒸馏用冷凝管 | 盛装Na2SiO3溶液的试剂瓶 |
A | B | C | D |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A.CaCO3与稀硝酸反应:![]()
B.FeSO4溶液与溴水反应:![]()
C.NaOH溶液与过量H2C2O4溶液反应:![]()
D.C6H5ONa溶液中通入少量CO2: ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,
装置如图所示,其中Y为CO2。下列说法合理的是( )
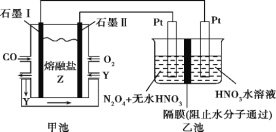
A.石墨Ⅰ是原电池的正极,发生氧化反应
B.甲池中的CO32-向石墨Ⅱ极移动
C.乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+
D.若甲池消耗标准状况下的氧气2.24L,则乙池中一定能产生氢气0.02mol
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某兴趣小组同学设计的原电池装置,下列叙述正确的是( )
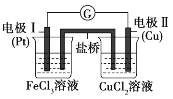
A.电极I上发生氧化反应
B.可将CuCl2溶液改为KCl溶液
C.该原电池的总反应为Fe3++Cu=Cu2++Fe2+
D.盐桥中装有含氯化钾的琼脂,K+移向CuCl2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:
![]() (
(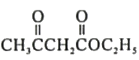 )
)![]()
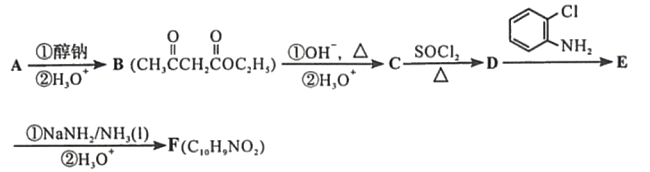
知:Ⅰ.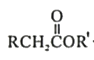
![]()
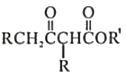
Ⅱ. 
![]()
![]()
![]()
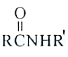
Ⅲ. 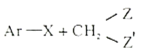
![]()

Ar为芳基;X=Cl,Br;Z或Z′=COR, CONHR,COOR等。
回答下列问题:
(1)实验室制备A的化学方程式为___________,提高A产率的方法是______________;A的某同分异构体只有一种化学环境的碳原子,其结构简式为_______________。
(2)C→D的反应类型为____________;E中含氧官能团的名称为____________。
(3)C的结构简式为____________,F的结构简式为____________。
(4)Br2和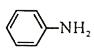 的反应与Br2和苯酚的反应类似,以
的反应与Br2和苯酚的反应类似,以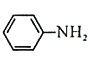 和
和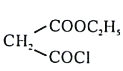 为原料合成
为原料合成 ,写出能获得更多目标产物的较优合成路线(其它试剂任选)________。
,写出能获得更多目标产物的较优合成路线(其它试剂任选)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于1mol/L的氨水,下列叙述正确的是(忽略溶液混合时的体积变化)( )
A.将标准状况下22.4L氨气溶于1 L水配成溶液,即可得到1mol/L的氨水
B.1mol/L的氨水的质量分数小于1.7%
C.1mol/L的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5mol/L
D.将1mol/L的氨水与3mol/L的氨水等质量混合后,所得氨水的物质的量浓度为2mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
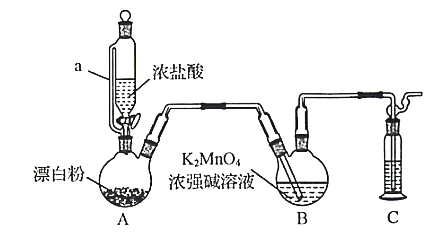
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
![]()
回答下列问题:
(1)装置A中a的作用是______________;装置C中的试剂为________________;装置A中制备Cl2的化学方程为______________。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是________________。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入___________(填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为______________(填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含![]() 的质量分数表达式为_________________。
的质量分数表达式为_________________。
下列关于样品组成分析的说法,正确的是__________(填标号)。
A.![]() 时,样品中一定不含杂质
时,样品中一定不含杂质
B.![]() 越大,样品中
越大,样品中![]() 含量一定越高
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
查看答案和解析>>
科目: 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )

A.并不是每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能不都相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com