
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.将混合气体中的氨液化有利于合成氨反应
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g)平衡体系增大压强可使其颜色变深
CO2(g)+NO(g)平衡体系增大压强可使其颜色变深
C.常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5
D.实验室中常用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】为减轻大气污染,必须要加强对工业废气和汽车尾气的治理,根据所学知识回答下列问题:
(1)化石燃料包括煤、石油和________。
(2)酸雨是指pH____(填“>”“<”或“=”)5.6的降水,煤的燃烧是导致酸雨形成的主要原因,而正常雨水的pH约为5.6,原因是__________________ (用化学方程式表示)。
(3)煤的气化是高效、清洁利用煤的重要途径,可将煤炼成焦炭,再将焦炭在高温下与水蒸气反应生成一氧化碳和氢气的化学方程式为_________,该反应的基本类型是_________。
(4)在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的气体和无毒的气体,该反应的化学方程式为__________________。
(5)在新能源汽车未普及时,如图所示为一种“节能减排”的有效措施,以下对乙醇作汽车燃料的描述错误的是__________(填字母)。
![]()
A.原料来源丰富 B.是可再生能源 C.燃烧完全没有污染
查看答案和解析>>
科目: 来源: 题型:
【题目】赤铜矿的成分是 Cu2O,辉铜矿的成分是 Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S + 2Cu2O![]() 6Cu + SO2↑,对于该反应的下列说法正确的是( )
6Cu + SO2↑,对于该反应的下列说法正确的是( )
A.该反应中的氧化剂只有 Cu2O
B.Cu2S 在反应中既是氧化剂又是还原剂
C.Cu 既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为 6∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。下列有关说法正确的是( )

A.线段AB代表Fe2+物质的量的变化情况
B.线段BC代表Fe3+物质的量的变化情况
C.线段DE所发生的离子反应方程式为2Fe2++Cl2===2Fe3++2Cl-
D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=1∶2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法不正确的是
A.5.5g超重水(T2O)中含有的中子数目为3NA
B.常温常压下,44gCO2与足量过氧化钠反应转移电子的数目为NA
C.常温常压下,42gC2H4和C4H8混合气体中含有氢原子的数目为6NA
D.0.1L0.5mol·L-1CH3COOH溶液中含有H+数目为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
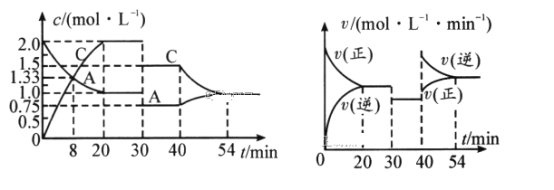
(1)0~20min,A的平均反应速率为__mol/(L·min);8min时,v正__v逆(填“>”“=”或“<”)。
(2)反应方程式中的x=__,30min时改变的反应条件是__。
(3)20~30min时反应的平衡常数__(填“>”“=”或“<”)3040min时反应的平衡常数。
(4)该反应的正反应为__(填“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是_min。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。

(1)物质A的化学式为___。
(2)H在潮湿空气中变成M的实验现象是__,化学方程式为___。
(3)A和水反应生成B和C的离子方程式为__,列出A的一种重要用途__。
(4)反应①的离子方程式为__,②加足量T的目的___。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2的工艺如下:

己知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为___,该新方法最突出的优点是___。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___;④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶势、充分反应后(ClO2-被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度___。(提示:2Na2S2O3+I2=Na2S4O6+2Nal)
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定25℃各含氯微粒浓度随pH的变化情况如图所示(Cl-没有画出)。
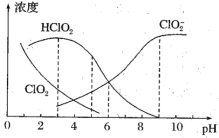
①酸性条件下NaClO2溶液中存在的Cl-原因是___(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]

(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为_____________。
(2)洗涤沉淀B的操作是___________________________________________________。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
方案Ⅱ.乙组同学的主要实验流程图如下:

按如下左图所示装置进行实验:


(4)该实验中装置B盛放的物质是_____________________,分液漏斗中__________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中干燥管C在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________________。
(6)有同学认为为了减少实验误差,在反应前后都要通入N2(如上右图),反应后通入N2的目的是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com