
科目: 来源: 题型:
【题目】一密闭容器中,反应mA(g)+nB(g) ![]() pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
A. 化学计量数:m+n>p B. 平衡向正反应方向移动了
C. 物质B的转化率增大了 D. 物质C的质量分数增加了
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,把1molN2和3molH2通入一个一定容积的密闭的容器里,发生如下反应:N2+3H2![]() 2NH3;当此反应进行到一定程度时,反应混和物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
2NH3;当此反应进行到一定程度时,反应混和物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的N2、H2和NH3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=__________。
(2)若a=0.5,则b=__________和c=__________。
(3)a、b、c取值必须满足的一般条件是:请用两个方程式表示,其中一个只含a和c,另一个只含b和c______。
查看答案和解析>>
科目: 来源: 题型:
【题目】取三份浓度均为0.1 mol/L,体积均为1 L 的CH3COONa 溶液中分别加入NH4Cl 固体、CH3COONH4固体、HCl 气体后所得溶液pH 变化曲线如图(溶液体积变化忽略不计)下列说法不正确的是

A.曲线 a、b、c 分别代表加入 CH3COONH4、NH4Cl、HCl
B.由图可知 Ka(CH3COOH)=Kb(NH3﹒H2O)=1×10-7
C.A点处 c(CH3COO-)>c(Na+)> c(NH4+)> c(OH-)> c(H+)
D.C点处 c(CH3COO-)+c(Cl-)+c(OH-)>0.1mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是

A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
查看答案和解析>>
科目: 来源: 题型:
【题目】通常检测 SO2 含量是否达到排放标准的反应原理是 SO2 +H2O2 + BaCl2 =BaSO4↓+ 2HCl,NA 表示阿伏伽德罗常数,下列说法正确的是()
A.上述反应生成 2.33 g BaSO4 沉淀时,转移电子数目为 0.01NA
B.17 g H2O2 中含有非极性键数目为 0.5NA
C.0.1 mol BaCl2 晶体中所含微粒总数为 0.3NA
D.25 ℃时,pH =1 的 HCl 溶液中含有 H+的数目为0.1 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)53克Na2CO3的物质的量是________,所含Na+和CO32-的物质的量各是_____________,
(2)在标准状况下,测得1.32 g某气体的体积为0.672 L。则此气体的摩尔质量_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】.Ba(NO3)2可用于生产烟花。某主要生产 BaCl2、BaCO3、BaSO4 的化工厂利用某种钡泥[主要含有 BaCO3、Ba(FeO2)2、极少量 CuCO3 等]制取 Ba(NO3)2 晶体,其部分工艺流程如下:
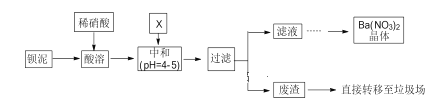
已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的 pH 分别为 3.2 和 9.7。
(1)酸溶时通常不使用浓硝酸的原因是__________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2 与HNO3 的反应化学方程式为____________。
(3)该厂结合本厂实际,中和选用的 X 为__________(填化学式);中和使溶液中__________(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到 Ba(NO3)2 晶体的操作依次为_____、过滤。
(5)该厂生产的 Ba(NO3)2 晶体含有少量 Cu2+ ,可通过洗涤的方法除去。证明晶体已经洗涤干净的操作方法是_______________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4 溶液解毒,涉及到的离子反应方程式为___________; 为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵是分析化学中重要的试剂,某实验小组制备和探究其分解产物的实验如下:I.制备硫酸亚铁铵
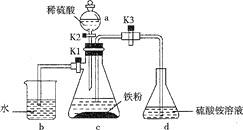
(1)仪器a的名称是__。
(2)将过量铁粉置于c中,加蒸馏水于b中,硫酸铵溶液于d中,按图连接好装置,打开K1、K2,关闭K3.使用铁粉“过量”的原因是___。
(3)关闭K1和K2,打开K3,c中浅绿色溶液流入d,其原因是___;d中析出沉淀,用化学方程式解释:___。
Ⅱ.探究硫酸亚铁铵的部分分解产物
假设气体产物仅有NH3、SO2、SO3(g)和H2O(g),设计如下所需装置进行实验;
已知:CaCl2+8NH3=CaCl2·8NH3
A.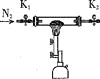 B.
B. C.
C.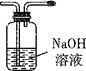 D.
D.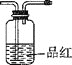 E.
E.![]()
①将I中制备的沉淀装入A,装置连接顺序为___,打开K1和K2,缓缓通入N2,一段时间后,关闭K1开始加热,实验后反应管中残留固体为红色粉末;
②B、D中有气泡冒出,还可观察到的现象分别为__,
③硫酸亚铁铵的分解方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3mol O2和0.3mol H2OB.![]() 个
个![]() 与0.1mol
与0.1mol ![]()
C.0.1mol ![]() 与0.15mol
与0.15mol ![]() D.0.1mol
D.0.1mol ![]() 与0.1mol
与0.1mol ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的量和摩尔质量的叙述,正确的是 ( )
A. 水的摩尔质量是18 g
B. 0.012 kg 12C中约含有6.02![]() 1023个碳原子
1023个碳原子
C. 1 mol水中含有2 mol氢和1 mol氧
D. 1 mol任何物质都含有6.02![]() 1023个分子
1023个分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com