
科目: 来源: 题型:
【题目】氰酸铵(NH4CNO)受热转化成尿素[CO(NH2)2]的反应在有机化学史上具有里程碑事件,打破了“有机物不能有无机物制得”的观念。在后来的实验中发现,尿素可以由氨气和二氧化碳反应生成,尿素也可以在一定条件下失去氨而缩合,如两分子尿素失去一分子氨,则形成二聚物--缩二脲。下列关于尿素及其缩合产物的说法中错误的是( )
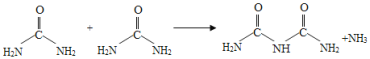
A.与尿素分子式相同的物质有不止一种
B.可以推测,尿素也可以缩合形成聚合产物
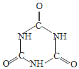
C.缩二脲中有肽键,因此缩二脲是一种二肽
D.若尿素生成三聚产物--缩三脲,则生成一分子缩三脲的同时,失去两分子氨
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。

(1)化学性质最不活泼的元素是____(填元素名称);
(2)氮原子的一种氢化物常用作燃料电池的燃料,其电子式为________;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是_________(填化学式);
(4)碳原子的氢化物和氯气在光照条件下发生第一步反应的化学方程式是_____________;
(5)第3周期中气态氢化物最稳定的是________;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是___________(写出一种).
(7)Na、Al最高价氧化物的水化物之间反应的产物通入少量二氧化碳,发生反应的离子方程式是_________________________________.
(8)结构式为 的有机物分子式是______,其中碳元素与氢元素的质量比m(C)∶m(H)=________(相对原子质量:H—1 C—12)。
的有机物分子式是______,其中碳元素与氢元素的质量比m(C)∶m(H)=________(相对原子质量:H—1 C—12)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)①写出“海洋元素”的元素符号_____________,②写出钡餐的化学式:_____________。
(2)镁失火时不能用二氧化碳灭火,用化学方程式表示其原因_____________。
(3)《新修本草》有云:“青矾( FeSO4·7H2O)本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”根据以上信息,写出“青矾”受热分解的化学方程式_____________。
(4)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:_____________MnO4ˉ+_____________H2O2+_____________=_____________Mn2++_____________H2O+_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+ H2O2+ BaCl2= BaSO4↓+ 2HC1 ,用NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 0.1 molBaCl2中所含离子总数约为0.3 NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17gH2O2中所含电子总数约为9 NA
D. 生成2.33gBaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224L
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向25 mL 0.1 mol.L-1NaOH溶液中逐滴滴加0.2 mol.L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是
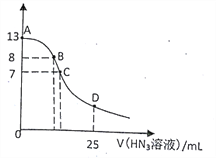
A. 水电离出的c(H+):A点小于B点
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)=12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性:苯甲酸>碳酸>苯酚,现将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与稀H2SO4共热后,加入足量的Na2CO3
B.加入足量的NaOH溶液,再通入足量的HCl
C.与足量的NaOH溶液共热后,再通入CO2
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关溴乙烷的说法正确的是( )
A.溴乙烷的电子式![]()
B.用溴乙烷制取乙二醇经过以下几步:消去![]() 加成
加成![]() 水解
水解
C.溴乙烷与KOH醇溶液反应:CH3CH2Br+H2O![]() C2H5OH+KBr
C2H5OH+KBr
D.向溴乙烷中滴入![]() 溶液检验其中的溴元素:
溶液检验其中的溴元素:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】对已达化学平衡的反应 2X(g)+Y(g)![]() 2Z(g) ΔH<0 下列说法正确的是
2Z(g) ΔH<0 下列说法正确的是
A.减小压强,逆反应速率增大,正反应速率减小,平衡向逆方向移动
B.升高温度,正、逆反应速率均增大,平衡向逆方向移动
C.除去部分的Z,正反应速率增大,逆反应速率减小,平衡向正方向移动
D.加入正催化剂,正、逆反应速率均增大,平衡向正方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在生产生活中有重要的作用。请回答下列问题:
(1)肼(N2H4)通常用作火箭的高能燃料,工业上常用次氯酸钠(NaClO)与过量的氨气反应制备肼,该反应的化学方程式为___;
(2)N2(g)+3H2(g)![]() 2NH3(g)为放热反应。800K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器为绝热恒容容器,三容器各自建立化学平衡。
2NH3(g)为放热反应。800K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器为绝热恒容容器,三容器各自建立化学平衡。
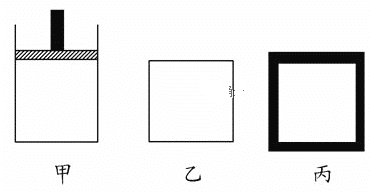
①达到平衡状态时,平衡常数K甲___K乙(填“>”、“<”或“=”);
②达到平衡状态时,N2的浓度c乙(N2)___c丙(N2);
(3)100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中的NO的平衡转化率与温度的关系曲线如图1所示,反应2NO2(g)
2NO2(g)中的NO的平衡转化率与温度的关系曲线如图1所示,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2所示。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2所示。

①图1中A、B、C三点表示不同温度、不同压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则___点对应的压强最大;
2NO2(g)达到平衡时NO的转化率,则___点对应的压强最大;
②对于反应2NO2(g)![]() N2O4(g),写出用平衡分压代替平衡浓度计算平衡常数的表达式Kp=___;依据图2,计算100kPa,25℃时,Kp=___(写清数值和单位)。
N2O4(g),写出用平衡分压代替平衡浓度计算平衡常数的表达式Kp=___;依据图2,计算100kPa,25℃时,Kp=___(写清数值和单位)。
(分压计算:某物质X的分压:P(X)=总压×X的物质的量分数)
查看答案和解析>>
科目: 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.含硫的煤燃烧时会产生SO2,对空气造成污染,且易形成酸雨。
(1)为了防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时生成的SO2和生石灰、O2共同反应生成硫酸钙。请写出该反应的化学方程式___。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
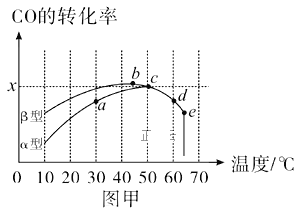
(2)a、b、c、d四点中,达到平衡状态的是__。
(3)已知c点时容器中O2浓度为0.02mol/L,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=__(用含x的代数式表示)。
(4)下列关于图甲的说法正确的是__。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高至一定温度后,催化剂失去活性
Ⅲ.活性炭还原法也是消除氮氧化物和硫氧化物的方法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:
C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=QkJ·mol-1
N2(g)+CO2(g) ΔH=QkJ·mol-1
在T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.60 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
(5)0~10min内,N2的平均反应速率v(N2)=__。
(6)若30min后升高温度至T2℃,重新达到平衡时,容器中NO、N2、CO2的浓度之比为7∶3∶3,则该反应的ΔH__0(填“>”、“=”、或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com