
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定条件下一定能大共存的是
A.c(H+)=c(OH-)溶液中:Fe3+、K+、Cl-、SO42-
B.麦芽糖溶液中:SO42-、MnO4-、K+、H+
C.![]() =1×1012的溶液中:Mg2+、Cu2+、SO42-、C1﹣
=1×1012的溶液中:Mg2+、Cu2+、SO42-、C1﹣
D.遇BaCl2能产生不溶于稀硝酸的白色沉淀的溶液中:NH4+、Ca2+、NO3﹣、Cl﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下表各组物质(或者它们的溶液)通过一步反应可实现如图所示的转化的是
选项 | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态_________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是_________________________________________。

(2)在一刚性密闭容器中,加入Ni/α-Al2O3催化剂并加热至1123K,使CH4和CO2发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),初始时CH4和CO2的分压分别为20kPa、25kPa,研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液之间进行)中,ΔH2>ΔH1的是
A.CO2(s)+C(s)=2CO(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
B.NH3 ·H2O(aq)+H+(aq)= NH4+ (aq)+H2O(l) ΔH1 H+(aq)+OH-(aq)= H2O(aq) ΔH2
C.N2(g)+O2 (g) ![]() 2NO(g) △H1 N2(g)+O2 (g)
2NO(g) △H1 N2(g)+O2 (g) ![]() 2NO(g) △H2
2NO(g) △H2
D.CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) △H1 CH4(g)+2O2(g)= CO2(g)+ 2H2O(g) △H2
查看答案和解析>>
科目: 来源: 题型:
【题目】瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将其与浓盐酸混合加热,产生了黄绿色气体。
(1)该反应的化学方程式为____________________。
(2)反应中氧化剂是_______(填化学式),锰元素的化合价________(填“升高”或“降低”)。若消耗了17.4 g MnO2,则生成标准状况下Cl2的体积是_______L,转移电子的物质的量是______mol。
(3)用此反应制得的氯气中常混有_______,要收集到干燥纯净的氯气,应使气体依次通过装有_______、_______的洗气瓶后再收集。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是进行气体性质实验的常用装置,液体一定不能充满试管的是
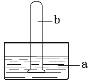
A.若a为水,b是HClB.若a为水,b是NO2
C.若a为水(滴有酚酞),b是NH3D.若a为NaOH溶液,b是Cl2
查看答案和解析>>
科目: 来源: 题型:
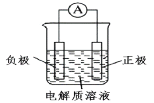
【题目】原电池原理应用广泛。
(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱。
如图所示,该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。写出该氧化还原反应的离子方程式:__________________________,装置中的负极材料是______(填化学式),正极反应式是_________________________。
(2)某研究性学习小组为证明2Fe3++2I-![]() 2Fe2++I2为可逆反应,设计如下方案:组装如图原电池装置,接通灵敏电流计,指针向右偏转(注:此灵敏电流计指针是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/LFeCl2溶液。
2Fe2++I2为可逆反应,设计如下方案:组装如图原电池装置,接通灵敏电流计,指针向右偏转(注:此灵敏电流计指针是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/LFeCl2溶液。
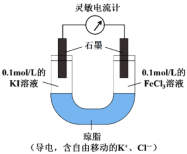
①实验中,“读数变为零”是因为___________________。
②“在右管中加入1mol/LFeCl2溶液”后,观察到灵敏电流计的指针_________偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴蓝(化学式Al2CoO4)是一种耐热、耐光、耐酸、耐碱腐蚀的蓝色颜料。某企业利用含铝锂钴废料(铝箱、CoO和Co2O3、Li2O)制备钴蓝的工艺流程如下:
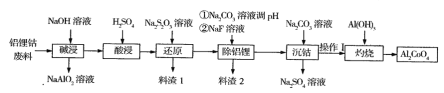
回答下列问题:
(1)碱浸时要有防火、防爆措施,原因是______,操作I的内容是_______。
(2)在实验室模拟工业生产时,也可用盐酸酸浸出钴,但实际工业生产中却不用盐酸,请 从反应原理分析不用盐酸浸出钴的主要原因___。
(3)写出“还原”过程中反应的离子方程式____。
(4)料渣2的主要成分是A1(OH)3 、____,写出灼烧时反应的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:______。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填字母)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质与水反应剧烈
D.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:______。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)______r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol·L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
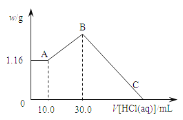
试回答:
(1)A点沉淀的化学式为______。
(2)写出A点至B点发生反应的离子方程式_______。
(3)求原混合物中AlCl3的质量____和NaOH的物质的量____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com