
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
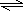 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+| 1 |
| 2 |
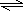 SO3(g)△H=-Q1 KJ/mol
SO3(g)△H=-Q1 KJ/mol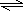 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+| 1 |
| 2 |
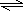 SO3(g)△H=-Q1 KJ/mol
SO3(g)△H=-Q1 KJ/mol| 50Q2 |
| Q1 |
| 50Q2 |
| Q1 |
| 1 |
| 9 |
| 1 |
| 9 |
查看答案和解析>>
科目: 来源: 题型:
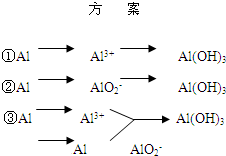 实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/mol | |||||
| 消耗H+ | 消耗OH- | |||||
| ① | 3 | 3 3 | ||||
| ② | 1 1 |
1 | ||||
| ③ | 3/4 |
| ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com