
科目: 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:

(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图Ⅰ)顶点的氮原子,这种碳氮化钛化合物的化学式为___。

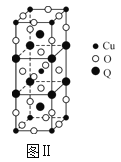
(2)图Ⅱ是由Q、Cu、O三种元素组成的一种高温超导体的晶胞结构,其中Cu为+2价,O为-2价,则Q的化合价为___价。
(3)一种新型阳极材料LaCrO3的晶胞如图Ⅲ所示,已知距离每个Cr原子最近的原子有6个,则图Ⅲ中___(填字母)原子代表的是Cr原子。

查看答案和解析>>
科目: 来源: 题型:
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用CsCO3,XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7,的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__;第一电离能I1(Si)__I1(Ge)(填![]() 或
或![]() )。
)。
(2)基态Ge原子核外电子排布式为__;SiO2,GeO2具有类似的晶体结构,其中熔点较高的是__,原因是__。
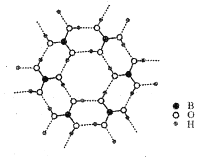
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为__;硼酸在热水中比在冷水中溶解度显著增大的主要原因是__。
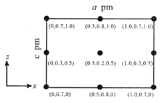
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7,属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为__;CsSiB3O7的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为__g·cm-3(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+ CH3OH(l)
CH3COOC6H13(l)+ CH3OH(l)
已知v正=k正·x(CH3COOCH3)·x(C6H13OH),v逆=k逆·x(CH3COOC6H13)·x(C6H13OH),其中v正,v逆为正、逆反应速率,k正,k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(a)随时间(t)的变化关系如图所示。
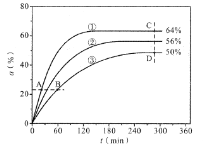
该醇解反应的ΔH__0(填![]() 或
或![]() )。348K时,以物质的量分数表示的化学平衡常数Kx=__(保留2位有效数字)。
)。348K时,以物质的量分数表示的化学平衡常数Kx=__(保留2位有效数字)。
在曲线①、②、③中,k正-k逆经值最大的曲线是__;A、B、C、D四点中,v正最大的是__,v逆最大的是__。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料.则达到平衡后,初始投料比__时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx__(填增大、小不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是__。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同的倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能/(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素基态原子价电子层的电子排布式为__;比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是__。
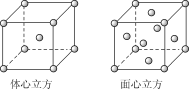
(2)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为__,Fe原子配位数之比为__。
查看答案和解析>>
科目: 来源: 题型:
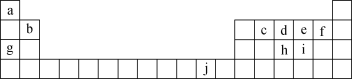
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。
回答下列问题:
(1)写出元素f的基态原子核外电子排布式:__。
(2)写出元素h的基态原子核外电子轨道表示式:__。
(3)ci2分子的电子式为__。
(4)第一电离能:h__(填“>”“<”或“=”,下同)i;电负性:g__b。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的叙述正确的是__(填字母)。
A.j位于元素周期表中第4周期ⅠB族,属于ds区元素
B.d的基态原子中,2p轨道为半充满,属于p区元素
C.最外层电子排布式为4s1,该元素一定属于第ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是第ⅢA族或ⅢB族
查看答案和解析>>
科目: 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH![]() 、SO
、SO![]() 、CO
、CO![]() 、K+ B. Na+、Ba2+、Ca2+、HCO
、K+ B. Na+、Ba2+、Ca2+、HCO![]()
C. Mg2+、SO![]() 、K+、Cl- D. K+、Cl-、Na+、SO
、K+、Cl- D. K+、Cl-、Na+、SO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的哑铃形C22-的存在,使晶胞沿一个方向拉长(该晶胞为长方体)。下列关于CaC2晶体的说法中正确的是( )
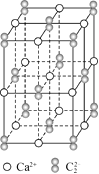
A.1个Ca2+周围距离最近且等距离的C22-数目为6
B.6.4gCaC2晶体中含阴离子0.1mol
C.该晶体中存在离子键和共价键
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如图所示。下列说法错误的是( )
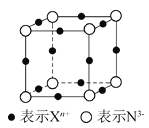
A.X元素的原子序数是19
B.该晶体中阳离子与阴离子个数比为3∶1
C.Xn+中n=1
D.晶体中每个Xn+周围有2个等距离且最近的N3-
查看答案和解析>>
科目: 来源: 题型:
【题目】热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
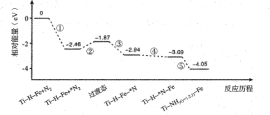
A. ①为N![]() N的断裂过程
N的断裂过程
B. ①②③在高温区发生,④⑤在低温区发生
C. ④为N原子由Fe区域向Ti-H区域的传递过程
D. 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com