
科目: 来源: 题型:
【题目】某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
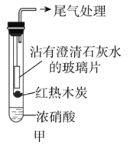
红热木炭未进入试管前,浓硝酸上方并无明显变化。当如图甲连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。
①液面上方出现红棕色气体,说明浓硝酸具有________(填选项字母)。
a.酸性 b.挥发性 c.不稳定性
②沾有澄清石灰水的玻璃片出现浑浊,________(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为________。
(2)乙同学设计实验如图乙。
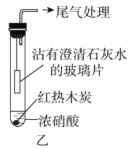
如图乙连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,________(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为________。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾能将NO、NO2 氧化成 NO3-,MnO4- 被还原为 Mn2+。
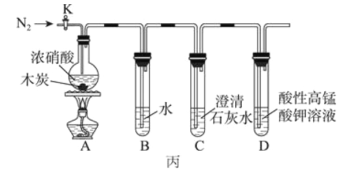
①如图连接装置后,需进行的实验操作为________;加热木炭与浓硝酸前需先通一段时间N2,目的为________________。
②装置A中木炭与浓硝酸反应的化学方程式为_________________________。
③能证明木炭被氧化的实验现象为________________________________________。
④D 装置中发生反应的离子方程式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
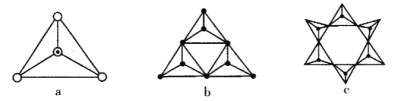
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。
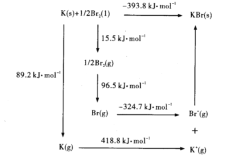
从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机金属配合物二茂铁(Fe(C5H5)2)的发现具有里程碑意义。已知二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法不正确的是( )
A.二茂铁属于分子晶体
B.在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键
C.已知,环戊二烯的结构式为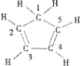 ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D.C5H5-中一定含有π键
查看答案和解析>>
科目: 来源: 题型:
【题目】以含Fe2O3、FeO、SiO2、Al2O3的混合物为原料,设计两种制备铁红(Fe2O3)的方案,部分产物已略去。
(方案1 )
![]()
(方案2 )
![]()
(1)溶液A所含阳离子有_________________
(2)加入双氧水的作用是_________________
(3)固体C 的成分是_________________(填化学式)
(4)试剂x可以选择_________________(填序号)
a.NaOH溶液 b.氨水 c.二氧化碳 d.稀硫酸
(5)用试剂x浸取原料发生的离子方程式为_________________
查看答案和解析>>
科目: 来源: 题型:
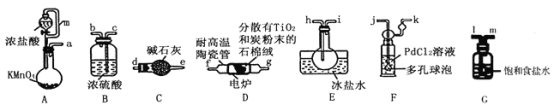
【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
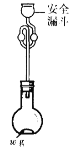
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。下列有关P4S3的说法中不正确的是( )

A.P4S3中各原子最外层均满足 8 电子稳定结构
B.P4S3中磷元素为+ 3 价
C.P4S3中 P 原子和 S 原子均为 sp3杂化
D.1molP4S3分子中含有 6mol 极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水,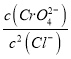 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①Al(OH)3固体的熔点为300℃,电离方程式为H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() 3OH-+Al3+;②无水AlCl3晶体易升华,溶于水的电离方程式为AlCl3=Al3++3Cl-;③熔融状态的HgCl2不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于Al(OH)3、AlCl3和HgCl2的说法正确的是( )
3OH-+Al3+;②无水AlCl3晶体易升华,溶于水的电离方程式为AlCl3=Al3++3Cl-;③熔融状态的HgCl2不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于Al(OH)3、AlCl3和HgCl2的说法正确的是( )
A.均为强电解质B.均为弱电解质
C.均为离子化合物D.均为共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌( ZnMn2O4)为电极材料,研制出一种水系锌离子电池,该电池的总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4(0<x<1)。下列说法正确的是( )
ZnMn2O4(0<x<1)。下列说法正确的是( )
A.放电时,Zn2+向负极迁移
B.充、放电过程中,仅锌元素的价态发生变化
C.充电时,阳极的电极反应式为ZnMn2O4 -2xe-=Zn1-XMn2O4+xZn2+
D.若维持电流强度为0.5A,放电10分钟,理论上消耗Zn的质量约为0.20 g (已知F =96500 C/mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com