
科目: 来源: 题型:
【题目】.二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00 mol CO2和2.00 mol H2以及催化剂发生反应:CO2(g)+H2(g) ![]() HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
实验编号 | 时间/min | 60 | 90 | 120 | 150 | 180 |
Ⅰ | T1/K | 1.50mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
Ⅱ | T2/K | 1.45mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)实验I中0~60min内用HCOOH表示的该反应的平均反应速率为____________。
(2)实验II反应开始时体系压强为P0,第90min时体系压强为P1,则P1:P0=_______。
(3)T2温度下反应的平衡常数为______________。
(4)比较实验温度T1____T2(填“>”或“<”),该反应的△H____0(填“>”、“=”或“<”)。
(5)下列说法正确的是_______(填编号)。
A.当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应达到平衡
B.容器中气体密度不再改变,不能判断该反应是否达到平衡
C.将HCOOH液化后分离既能提高转化率又能加快反应速率
D.选用更高效的催化剂可提高生产效率
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应有物质的变化过程中还有能量的转化,据此回答下列问题:
(1)已知甲醇的燃烧热为725.8kJ·mol-1,写出表示其燃烧热的热化学方程式:_______。
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI (g)分子中化学键断裂时需吸收的能量为_____kJ。
(3)己知:CO(g)+2H2(g) →CH3OH(g)△H1=-90.1 kJ·mol-1;3CH3OH(g) ![]() CH3CH=CH2(g)+H2O(g) △H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为________。
CH3CH=CH2(g)+H2O(g) △H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为________。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池。其工作原理示意如图:
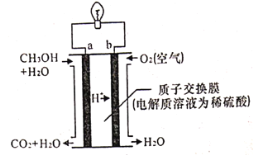
则其负极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
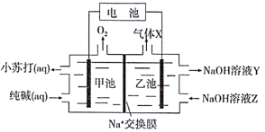
上述装置工作时,下列有关说法正确的是( )
A. 乙池电极接电池正极,气体X为H2
B. Na+由乙池穿过交换膜进入甲池
C. NaOH溶液Z比NaOH溶液Y浓度小
D. 甲池电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )

A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目: 来源: 题型:
【题目】硼(B)、铝及其化合物在化学中有重要的地位。请回答下列问题:
Ⅰ.(1)与B的基态原子电子排布式中成单电子数相同的第二周期元素还有______(填写元素符号)。
Ⅱ.硼酸(H3BO3)是白色片状晶体(层状结构如图1),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
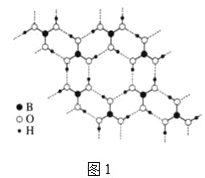
(2)硼酸分子以范德华力、共价键和氢键形成环状结构,每个含有B原子的环中平均含有B原子的个数为______个。其中B原子的杂化类型为______。
(3)加热时,硼酸的溶解度增大,主要原因是______。
(4)硼酸是一元弱酸,其分子式亦可写为B(OH)3,在水中电离时,硼酸结合水电离出来OH-的而呈酸性,写出硼酸的电离方程式______。
(5)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子的结构式或结构简式为______
(标出配位键)。
Ⅲ.硼氢化钠是一种常用的还原剂。其晶胞结构如图2所示:
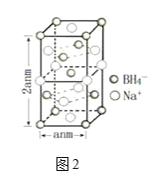
(6)该晶体中Na+的配位数为______。
(7)若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为______。
(8)LiAlH4也是一种特殊的还原剂,可将羧酸直接还原成醇:CH3COOH![]() CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
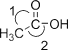
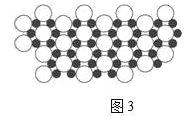
Ⅳ.(9)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,如图3是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为______。
查看答案和解析>>
科目: 来源: 题型:
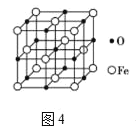
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的电子排布式为______。
(2)FeSO4常作净水剂和补铁剂,SO42-的立体构型是______。
(3)羰基铁[Fe(CO)5]可作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含______molσ键。
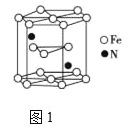
(4)氮化铁晶体的晶胞结构如图1所示(Fe3+离子为六方最密堆积)。该晶体中铁、氮的微粒个数之比为______。在该晶胞中,与Fe3+紧邻且等距离的Fe3+数目为______。
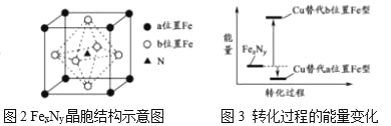
(5)某铁氮化合物(FexNy)的晶胞如图2所示,N原子位于b位置Fe形成的空隙,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图3所示,其中更稳定的Cu替代型产物的化学式为______。
(6)氧化亚铁晶体的晶胞如图4所示。已知:氧化亚铁晶体的密度为ρg/cm3,NA代表阿伏伽德罗常数的值,Fe2+与O2-最短核间距为______pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )
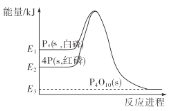
A. P4(s,白磷)=4P(s,红磷) ΔH>0
B. 以上变化中,白磷和红磷所需活化能相等
C. 白磷比红磷稳定
D. 红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是( )
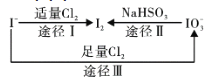
A.氧化性的强弱顺序为:Cl2>IO3->I2
B.途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
C.一定条件下,I-与IO3-反应可能生成I2
D.向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氯化钠晶胞(如图)的说法正确的是( )
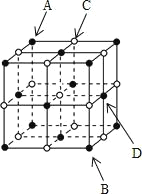
A.每个晶胞含有6个Na+和6个Cl-
B.晶体中每个Na+周围有8个Cl-,每个Cl-周围有8个Na+
C.晶体中与每个Na+最近的Na+有8个
D.将晶胞沿体对角线AB作投影,CD两原子的投影将相互重合
查看答案和解析>>
科目: 来源: 题型:
【题目】以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:

下列说法不正确的是
A. 装置②中试剂可以是NaOH溶液
B. 装置③的作用是干燥O2
C. 收集氧气应选择装置a
D. 装置②、③之间应增加盛澄清石灰水的洗气瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com