
科目: 来源: 题型:
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
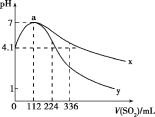
A.a点水的电离程度最大
B.该温度下H2S的Ka1≈10-7.2
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
查看答案和解析>>
科目: 来源: 题型:
【题目】美国斯坦福大学的工程师设计出一种从污水“提取”潜在电能的新型微生物电池,该电池能将生活污水中的有机物分解同时发电,电池结构如图所示。已知a电极为惰性材料,b电极为Ag2O。下列说法不正确的是( )
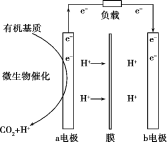
A.a电极是负极,b电极是正极
B.b电极发生的反应是Ag2O+2e-+2H+=2Ag+H2O
C.a电极每生成标准状况下2.24LCO2,可向b电极转移0.1mol电子
D.高温条件下,该电池不能正常工作
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如图:

已知:R1CH2COOCH2CH3+R2COOCH2CH3![]()
![]() +CH3CH2OH
+CH3CH2OH
(1)化合物A的名称是_____。
(2)反应②和⑤的反应类型分别是_____、_____。
(3)写出C到D的反应方程式_____。
(4)E的分子式_____。
(5)F中官能团的名称是_____。
(6)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四组峰,且峰面积之比为6:2:1:1。写出两种符合要求的X的结构简式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】指定条件的同分异构体。
(1)分子式为C3H6O,不能使溴的CCl4褪色,其核磁共振氢谱为单峰,其结构简式为:_____。
(2)分子式为C4H9Cl的物质,核磁共振氢谱表明其只有一种化学环境的氢;其结构简式为_____。
(3)某烃的含氧衍生物的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰。其结构简式为____。
(4)分子式为C7H5O2Cl的同分异构体中含有苯环且能发生银镜反应的共有_____种,[不考虑-OCl这种基团]其中核磁共振氢谱显示有三种不同化学环境的氢,且峰面积比为2:2:1的是____(写结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法错误的是( )
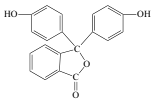
A.酚酞的分子式为C20H14O4
B.酚酞具有弱酸性,且属于芳香族化合物
C.1mol酚酞最多与2molNaOH发生反应
D.酚酞在碱性条件下能够发生水解反应,呈现红色
查看答案和解析>>
科目: 来源: 题型:
【题目】加热蒸干氯化镁溶液时因水解不完全会得到一种灰白色沉淀——碱式氯化镁,化学式可表示为Mgx(OH)yClz·nH2O,设计如图装置验证其化学式。下列有关实验的说法不正确的是( )
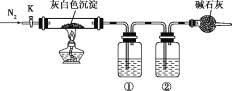
A.碱式氯化镁受热分解可以生成氧化镁、氯气和水
B.结束反应时,先停止加热,通一段时间N2后再关闭活塞K
C.①②中依次盛装浓硫酸、氢氧化钠溶液
D.只需称量原样品质量、反应结束后硬质玻璃管中剩余固体质量以及装置①增重的质量即可推出其化学式
查看答案和解析>>
科目: 来源: 题型:
【题目】中美学者携手发现了全硼富勒烯团簇—B40。B40团簇的结构,酷似中国的红灯笼(如图)。该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要应用前景。下列有关说法正确的是( )

A.B40与石墨烯的结构相同,二者互为同素异形体
B.43.2g该物质含有2.408×1024个原子
C.B40中既含有极性键又含有非极性键
D.全硼富勒烯团簇是一种新型的高分子材料
查看答案和解析>>
科目: 来源: 题型:
【题目】MnCO3可用作电器元件材料,也可作为瓷釉、颜料的制作原料。工业上用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)制备MnCO3:
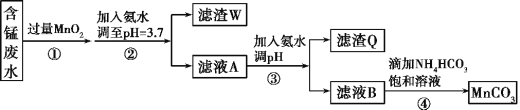
已知:几种金属离子沉淀的pH如下表。
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)①中加入过量MnO2的作用是___,滤渣W的成分是___。
(2)过程③中,调pH的目的是___。
(3)过程④中有CO2生成,则生成MnCO3的离子方程式是___。
(4)过程④中得到纯净MnCO3的操作方法是___,该过程中副产品的化学式是___。
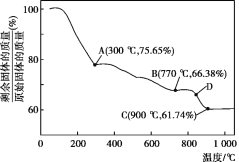
(5)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___;图中点D对应固体的成分为___(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年![]() 确认了四种新元素,其中一种为
确认了四种新元素,其中一种为![]() ,中文名为“
,中文名为“![]() ”。元素
”。元素![]() 可由反应:
可由反应:![]() +
+![]() =
=![]() +3
+3![]() 得到。该元素的质子数为______,
得到。该元素的质子数为______,![]() 与
与![]() 互为_________。
互为_________。
(2)![]() 位于元素周期表中第
位于元素周期表中第![]() 族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________.该分子内存在的共价键类型有_______。
族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________.该分子内存在的共价键类型有_______。
(3)该族中的另一元素P能呈现多种化合价,其中![]() 价氧化物的分子式为______,
价氧化物的分子式为______,![]() 价简单含氧酸的分子式为______。
价简单含氧酸的分子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com