
科目: 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式_____________。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。
(2)利用______的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_______。然后再调节溶液的pH约为5,目的是________。
(4)“粗硼酸”中的主要杂质是___________________________(填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
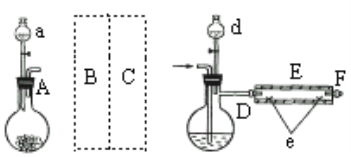
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
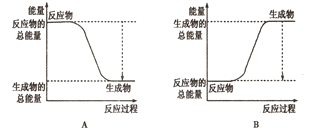
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时![]() (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
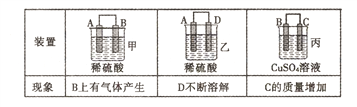
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物用C6H10O5表示。下列有关说法正确的是

A. b电极为该电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目: 来源: 题型:
【题目】断裂1mol化学键所需要的能量如下:
化学键 | N-N | O=O | N≡N | N-H |
键能kJ·mol-1 | a | 500 | 942 | 391 |
肼(N2H4)的有关反应能量变化如图所示,下列说法正确的是( )

A. 该图表示:1molN2H4与1molO2反应生成1molN2和2molH2O反应热△H=-2752kJ·mol-1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) △H=+2752kJ·mol-1
D. 当有2molH2O(g)生成时,放出534kJ·mol-1的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】有两种金属组成的合金A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:

(1)溶液C的溶质主要是____________________(填化学式)。
(2)写出反应②的化学方程式_______________________________________________。描述D变F的实验现象_______________________________________________。
(3)写出反应C→E的离子方程式________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ____ | ____ |
(Ⅱ)酒精(水) | ____ | ____ |
①检验的试剂:a.无水硫酸铜b.酸性高锰酸钾溶液c.水d.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜b.乙酸c.新制的生石灰d.溴水
(2)如图所示,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
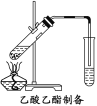
试回答:在右试管中通常加入__________溶液,实验生成的乙酸乙酯,其密度比水小,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为__________(只填名称)。反应中加入浓硫酸的作用是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】叶蝉散对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长。工业上用邻异丙基苯酚合成叶蝉散的过程如下:
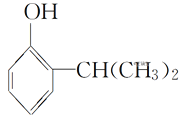 (邻异丙基苯酚)
(邻异丙基苯酚)![]()
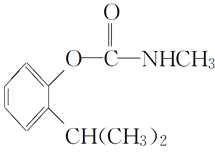 (叶蝉散)
(叶蝉散)
下列有关说法正确的是( )
A.叶蝉散的分子式是C11H16NO2B.邻异丙基苯酚的核磁共振氢谱有7个峰
C.叶蝉散分子中含有羧基D.邻异丙基苯酚与![]() 互为同系物
互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:
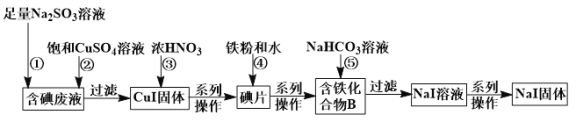
已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_____。

(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是__________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com