
科目: 来源: 题型:
【题目】常温下用惰性电极电解200 mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)。
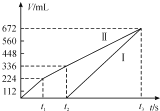
(1)曲线___(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)NaCl的物质的量浓度为___,CuSO4的物质的量浓度为___。
(3)t2时所得溶液的pH为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组对某无色水样进行检验,已知水样中只可能含有K+、Mg2+、Cu2+、Al3+、CO32-、SO42-、C1-中的若干种离子。该小组取100mL水样进行实验,先滴加硝酸钡溶液,再滴加1mol·L-1的硝酸,实验过程中沉淀质量变化情况如图所示,下列分析错误的是
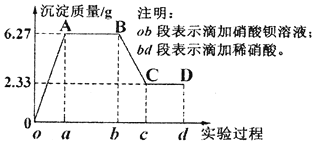
A. 一定含有的离子是:K+、SO42-、CO32-
B. BC段反应的离子方程式:BaCO3+2H+=Ba2++CO2↑+H2O
C. K+物质的量浓度的范围是: c(K+)≥0.6mol/L
D. 取少量水样置于试管中,滴加硝酸银溶液,可检验水样中是否含有C1-
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、SO42-、SO32-、Cl-、Fe2+、Fe3+、CO32-中的若干种,且各离子浓度均相同。为确定其组成现进行如下实验:
①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液加入足量NaOH溶液,有沉淀生成,微热,有气体产生
下列说法正确的是( )
A.无法确定原溶液中是否存在SO32-
B.是否存在![]() 需要通过焰色反应来确定
需要通过焰色反应来确定
C.CO32-肯定不存在,Fe2+、Fe3+至少有一种
D.溶液中存在NH4+、SO42-、Cl-、Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(i)CH4(g)+CO2(g)![]() 2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
(ii)CO(g)+2H2(g)![]() CH3OH(g) △H2=﹣90.1kJ·mol﹣1
CH3OH(g) △H2=﹣90.1kJ·mol﹣1
(iii)2CO(g)+O2(g)![]() 2CO2(g) △H3=﹣566.01kJ·mol﹣1
2CO2(g) △H3=﹣566.01kJ·mol﹣1
用CH4和O2直接制备甲醇蒸气的热化学方程式为___。
(2)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下:
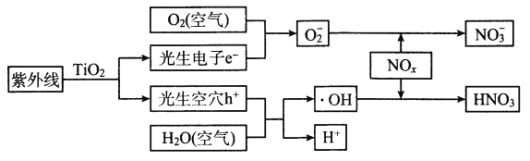
下列关于该“消除”过程的叙述不正确的是
A. 部分光能转变为化学能
B. 消除总变化为NOx+O2+H2O→HNO3
C. 消除反应能全天候发生
D. 使用纳米TiO2的消除效率更高
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电化学装置的说法正确的是 ( )
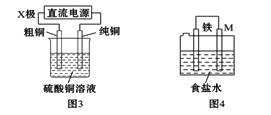
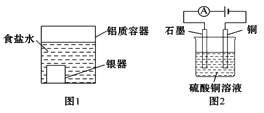
A. 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-=2Ag+S2-
B. 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变
C. 图3装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼
D. 图4装置中若M是铜,则该装置能防止铁被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研小组研究采用BMED 膜堆(示意图如右),模拟精制浓海水为原料直接制备酸碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)。已知: 在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法错误的是( )
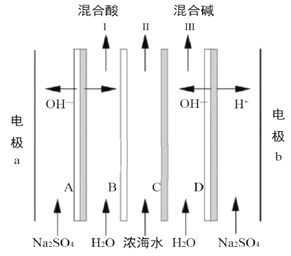
A. 电极a连接电源的正极 B. B为阳离子交换膜
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生 D. Ⅱ排出的是淡水
查看答案和解析>>
科目: 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态 K 原子中,核外电子占据的最高能层的符号是_____,占据该能层电子的电子云轮廓图形状为_____。K 和 Cr 属于同一周期,且核外最外层电子构型相同,但金属 K 的熔 点、沸点等都比金属 Cr 低,原因是_____。
(2)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为____________,中心原子的杂化类型为_______________ 。
(3)KIO3 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结 构,边长为 a=0.446nm,晶胞中 K、I、O 分别处于顶角、体心、面心位置, 如图所示。K 与 O 间的最短距离为_____nm,与 K 紧邻的 O 个数为_____。
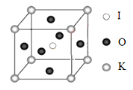
(4)在 KIO3 晶胞结构的另一种表示中,I 处于各顶角位置,则 K 处于_____________位置,O 处于_____位置。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组向50mLBa(NO3)2和Al(NO3)3的混合溶液M中逐滴加入K2SO4和KOH的混合溶液N,产生沉淀的物质的量(n)随加入溶液N的体积(V)变化的关系如图。下列说法错误的是( )

A.溶液N中K2SO4和KOH的物质的量浓度均为1molL-1
B.X点沉淀的组成为0.09molBaSO4和0.03molAl(OH)3
C.溶液M中含有0.11molBa(NO3)2和0.03molAl(NO3)3
D.Y点到Z点之间发生的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]

①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(p1、p2、p3、p4)的大小顺序为___,理由是___。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,n(H2O)∶n(C2H4)=0.6∶1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可采取的措施有___、___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com