
科目: 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3和1molO2。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g) ΔH =-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3和1molO2。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强P:P丙>P甲=2P乙
B.气体的总物质的量n:n丙>n甲>n乙
C.SO3的体积分数∮:∮甲=∮丙>∮乙
D.反应热量的数值Q:197>Q丙>Q甲>Q乙
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分Al2O3、Fe2O3、SiO2)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)写出步骤①中所发生反应的化学方程式____
(2)沉淀1是_________(写化学式);沉淀2是________(写化学式)。
(3)写出步骤②中所发生反应的离子方程式__________
(4)用氧化铝冶炼铝的化学方程式是______
(5)请设计另一个实验方案提取氧化铝________
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组利用实验室中的一瓶未知白色固体粉末进行了如下实验:
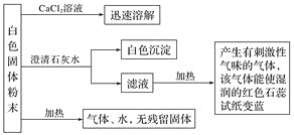
请回答下列问题:
(1)白色沉淀为______________________(填化学式,下同),产生的有刺激性气味的气体是_____________________。
(2)该白色固体粉末是___________________(填化学式)。
(3)写出该白色固体粉末受热分解的化学方程式:_______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图(I)为全钒电池,电池工作原理为:2H++VO2++V2+![]() VO2++V3++H2O。装置(Ⅱ)中的电解液是硝酸、硫酸的混合水溶液,当闭合开关K时,铂电极上生成NH2OH。则下列说法正确的是( )
VO2++V3++H2O。装置(Ⅱ)中的电解液是硝酸、硫酸的混合水溶液,当闭合开关K时,铂电极上生成NH2OH。则下列说法正确的是( )
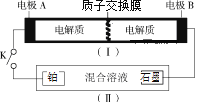
A.闭合K时,全钒电池负极区pH基本不变
B.闭合K时,铂电极的电极反应式为:NO3ˉ+6eˉ+5H2O=NH2OH +7OHˉ
C.全钒电池充电时,电极B上发生还原反应
D.全钒电池放电时,电极B上发生的反应为:VO2++2H++e-=VO2++H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】顺式乌头酸是一种重要的食用增味剂,其结构如下图所示。下列说法正确的是
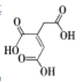
A.该有机物的分子式为:C6H8O6
B.该有机物只含有一种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.等物质的量的顺式乌头酸分别与足量的NaHCO3和Na反应,产生相同条件下的气体体积之比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
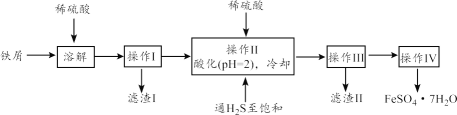
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)工业上若用过量稀硝酸溶解铁屑,则会产生污染性气体,其反应离子方程式是_____。
(2)操作II中,通入硫化氢至饱和的目的是_________;在溶液中用硫酸酸化至pH=2的目的是_____。
(3)常温下,Ksp[Fe(OH)3]=4.0×10-38,则Fe3+的水解常数为_____。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_____。
(5)久置的绿矾(FeSO4·7H2O)被空气中O2部分氧化,生成Fex(OH)y(SO4)z·wH2O。现测定其组成,步骤如下(假设杂质不参与反应,且每步反应均完全进行):
称取三等份固体样品。
第一份样品经足量稀硫酸溶解后,用250mL容量瓶中定容,量取25.00mL待测溶液于锥形瓶中,用0.03mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积为20.00mL(滴定时反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。滴定后溶液经控制pH沉淀Fe3+、过滤、洗涤、烘干并灼烧,最终得到0.32gFe2O3。(Fe2O3式量160)
第二份样品经足量稀盐酸溶解后,再加入过量BaCl2溶液,经过滤、洗涤、烘干,得9.32gBaSO4沉淀。(BaSO4式量233)
第三份样品经高温充分灼烧后,共收集到4.05gH2O。试推导该物质(Fex(OH)y(SO4)z·wH2O)的化学式(写出计算过程,x、y、z、w为最简整数比)______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“盐泥”是氯碱工业中产生的。盐泥中含 NaCl(15%~20%)、Mg(OH)2(15%~20%)、
CaCO3(15%~20%)和BaSO4 等不溶于酸的物质。用“盐泥”生产七水硫酸镁,设计了如下工艺流程:

(1)电解食盐水前,为除去粗食盐水中的 Mg2+、Ca2+、SO42-等杂质离子,下列试剂加入的先后顺序合理的是_____(填序号)。
A.碳酸钠溶液 B.氢氧化钠溶液 C.氯化钡溶液 D.盐酸
(2)已知Ksp[Mg(OH)2]=6.0×10-12。设食盐水中 Mg2+的浓度为 0.06 mol·L-1,则加入氢氧化钠溶液后使溶液的 pH≥_____才可能产生 Mg(OH)2 沉淀。
(3)氯碱工业上电解食盐水阴极发生的反应是_____。
(4)三种化合物的溶解度(S)随温度变化曲线见下图
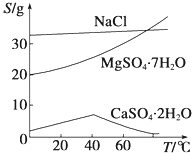
在“过滤Ⅰ” 中需要趁热过滤,其主要原因是_________;滤渣的主要成分有不溶于酸的物质、_________。
(5)检验 MgSO4·7H2O 中杂质是否洗涤干净的操作是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列物质间的转化均能实现的有( )
①NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
②Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
③AgNO3(aq)![]() [Ag(NH2)2]+(aq)
[Ag(NH2)2]+(aq)![]() Ag(s)
Ag(s)
④Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
⑤NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
⑥MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
⑦N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO47H2O)和KClO3在水溶液中反应得到。下列说法不正确的是( )
A.KClO3作氧化剂,每生成1mol[Fe(OH)SO4]n消耗![]() molKClO3
molKClO3
B.生成聚合硫酸铁后,水溶液的pH一定增大
C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水
D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强
查看答案和解析>>
科目: 来源: 题型:
【题目】铝及铝的化合物有着极为广泛的用途。
(1)金属铝的生产是以Al2O3为原料,在熔融状态下用石墨做阴极和阳极进行电解:
2Al2O3![]() 4Al+3O2↑,则电解时不断消耗的电极是_____(填“阳极”或“阴极”)
4Al+3O2↑,则电解时不断消耗的电极是_____(填“阳极”或“阴极”)
(2)铝片、石墨、空气和海水构成的原电池可用于航标供电,该原电池正极的电极反应是_____。
(3)泡沫灭火器中NaHCO3溶液和Al2(SO4)3溶液发生反应的离子方程式是______。
(4)在配制AlCl3溶液时,防止溶液出现浑浊现象,溶液中应加入_____。
(5)Mg(OH)2固体能除去镁盐溶液中Al3+,原因是_____。(用离子方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com