
科目: 来源: 题型:
【题目】我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图所示),促进了世界制碱技术的发展.下列有关说法正确的是( )

A.沉淀池中的反应物共含有五种元素
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】用废铁屑制备磁性胶体粒子,制取过程如下:

下列说法不正确的是
A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B. 通入N2是防止空气中的O2氧化二价铁元素
C. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的浓度比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
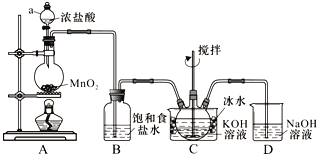
已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________,装置C中三颈瓶置于冰水浴中的目的是______________________。
(2)装置B吸收的气体是____________(写化学式),装置D的作用是____________________。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯置于冰水浴中,向其中加入________________,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是
①20 g D2O含有的电子数为10NA
②含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
③1 L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
④ 在标准状况下22.4 L SO3的物质的量为1mol
⑤25℃时,pH=12的l.0LNaClO溶液中水电离出的OH-的数目为0.01NA
⑥常温下,5.6 L NO和5.6 LO2的混合气体中含有的分子数为0.5NA
⑦l mol Na2O2与水完全反应时转移电子数为2NA
A. ③⑥⑦ B. ①③⑤ C. ①②④ D. ④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
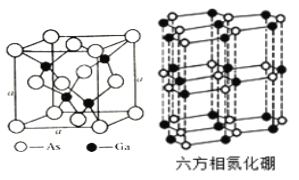
【题目】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅原子电子占据的最高能层符号是_____,其中能量最高的电子所占据能级的原子轨道有_____个伸展方向,原子轨道呈_____形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________(用元素符号表示)。H2SeO3的酸性_______H2SeO4(填“强于”或“弱于”),原因是___________(从分子结构的角度回答)。
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如右图所示。六方相氮化硼______π键(填“含有”或“不含”),其质地软的原因是_________。NaBH4是一种重要的储氢载体,阴离子的的立体结构_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于碳酸钠和碳酸氢钠的比较中,错误的是
A. 二者在一定的条件下可以相互转化
B. 可以用澄清石灰水对二者进行鉴别,能产生白色沉淀的为碳酸钠
C. 等质量的碳酸钠与碳酸氢钠与足量盐酸反应,后者更剧烈,前者产生二氧化碳少
D. 将二氧化碳通入到饱和碳酸钠溶液中,有浑浊产生,原因之一是碳酸钠溶解度更大
查看答案和解析>>
科目: 来源: 题型:
【题目】I.配制![]() 的
的![]() 溶液时,如果只存在下列问题,溶液的浓度如何变化?(填“偏大”“偏小”或“不变”)
溶液时,如果只存在下列问题,溶液的浓度如何变化?(填“偏大”“偏小”或“不变”)
(1)向容量瓶中加蒸馏水低于刻度线,其结果_____________;
(2)定容时观察刻度线仰视,其结果_____________。
II.(1)实验室加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为:__________________________。
(2)请在下列装置中选择实验室制备氨的发生装置:_____________(将编号字母填入空格处,下同);为了得到纯净的氨,请在下列试剂中选择干燥氨的试剂:_____________。
装置有:
A B
B![]() C
C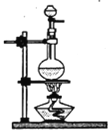 D
D![]() E
E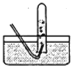 F
F![]() G
G![]() H
H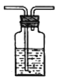
试剂有:a.![]() 溶液b.澄清石灰水c.浓硫酸d.饱和
溶液b.澄清石灰水c.浓硫酸d.饱和![]() 溶液e.碱石灰f.品红溶液g.湿润的红色石蕊试纸
溶液e.碱石灰f.品红溶液g.湿润的红色石蕊试纸
查看答案和解析>>
科目: 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化钙⑧ 氮气
A.③⑤⑦⑧B.⑤⑦⑧C.⑤⑧D.⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)工业上常用铝土矿冶炼金属铝。
①铝土矿的主要成分为![]() 和
和![]() ,其中
,其中![]() 属于____________(填“酸性”“碱性”或“两性”)氧化物;
属于____________(填“酸性”“碱性”或“两性”)氧化物;
②冶炼过程中需要用到氨,氨溶于水所得溶液呈____________(填“酸性”或“碱性”);
③利用金属活动性的不同,可以采用不同的冶炼方法,制取单质铝应采取_____________(填“热还原法”或“电解法”)。
(2)工业上合成氨的反应为:![]() ,一定条件下,将
,一定条件下,将![]() 和
和![]() 置于
置于![]() 的密闭容器中,
的密闭容器中,![]() 后测得
后测得![]() 为
为![]() 。
。
①用![]() 表示该反应的速率为___________;
表示该反应的速率为___________;
②其他条件不变时,再通入![]() ,该反应的速率将_____________(填“增大”或“减小”)。
,该反应的速率将_____________(填“增大”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com