
科目: 来源: 题型:
【题目】研究化学反应是为了更好的利用化学反应。回答下列问题:
(1)在①置换反应 ②化合反应 ③分解反应 ④复分解反应 四种基本反应类型中,一定属于氧化还原反应的是_____________(填标号)。
(2)探究离子反应的实验装置如图。向滴有几滴酚酞的0.01 mol·L-1 Ba(OH)2溶液中逐滴滴入0.05mol·L-1 H2SO4溶液,直至过量。

①Ba(OH)2的电离方程式为__________;开始滴加0.05 mol·L-1 H2SO4时,反应的离子方程式为____________________;
②酚酞由红色变为无色时,观察到的实验现象还有____________。
(3)已知:a.向可溶性盐MnSO4的酸性溶液中加入 NaBiO3溶液,溶液变成紫红色,且有Bi3+离子生成;b.实验室常用高锰酸钾固体与浓盐酸在常温下反应制取氯气。
①写出a中反应的离子方程式________________________________;
②KMnO4、NaBiO3、Cl2的氧化性由强到弱的顺序为______________;
③某同学用盐酸酸化NaBiO3溶液,你认为是否合理,你的判定及理由是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由几种离子化合物组成的混合物中含有以下离子中的若干种:K+、Cl-、NH![]() 、Mg2+、Ba2+、CO
、Mg2+、Ba2+、CO![]() 、SO
、SO![]() 。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验。
。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验。
实验序号 | 实验内容 | 实验结果 |
1 | 加入AgNO3溶液 | 有白色沉淀生成 |
2 | 加入足量NaOH溶液并加热 | 收集到气体1.12 L(标准状况下) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后过滤、洗涤、干燥、称量 | 第一次称量读数为6.27 g,第二次称量读数为2.33 g |
请回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是________。
(2)试确定100 mL溶液中一定存在的阴离子及其物质的量浓度(可不填满)。
阴离子符号 | 物质的量浓度(mol·L-1) |
_______ | ___________ |
______ | _______________ |
(3)K+是否存在?________(填“存在”或“不存在”),判断的理由是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.铁与盐酸反应:2Fe+6H+==2 Fe3++ H2↑
B.在氯化铝溶液中滴加过量的氨水:Al3++4 OH﹣═ AlO![]() +2 H2O
+2 H2O
C.向氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
D.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH﹣═ Fe(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业烟气中含有CO、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如图所示。

(1)SO2的浓度:Ⅰ______Ⅱ(填“>”或“<”)。
(2)图示过程中可以循环利用的物质是______(填化学式)。
(3)上述吸收过程中发生的主要反应的化学方程式是______。
(4)解吸过程需要加热,在这个过程中常伴有少量SO42-产生。
①证明产物中含SO42-的实验方法是:取少量解吸后的溶液,______(填操作和现象)。
②产生SO42-的原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在空气中加热S粉和Fe粉的混合物,可观察到下列现象:
(1)有淡蓝色火焰,且生成刺激性气味的气体。
(2)混合粉末变红,放出热量,最后变成黑色固体。
(3)不时有火星从混合物中射出。
请分别写出以上三种情况发生反应的化学方程式:__________、__________、__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
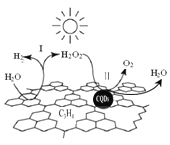
A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是( )
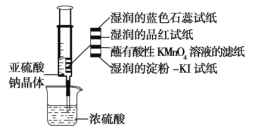
A.湿润的蓝色石蕊试纸先变红后褪色
B.湿润的品红试纸褪色,证明SO2具有漂白性
C.湿润的淀粉-KI试纸未变蓝,说明SO2的氧化性强于I2
D.蘸有酸性KMnO4溶液的滤纸褪色,证明SO2具有漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】在反应:11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4中,7.5 mol CuSO4可氧化磷原子的物质的量为( )
A.1.5 mol B.3 mol C.5 mol D.6 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
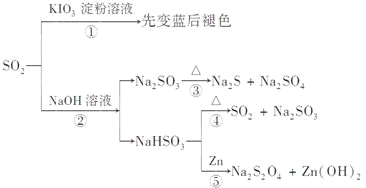
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com