
科目: 来源: 题型:
【题目】某有机物M结构简式为![]() ,其合成线路如下:
,其合成线路如下:
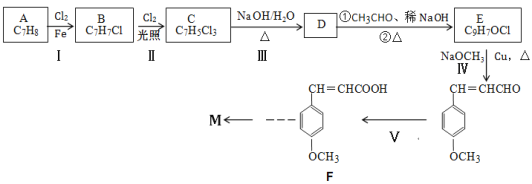
已知①通常在同一个碳原子上连有两个羟基不稳定,易脱水成羰基,即 +H2O
+H2O
②R1CHO+R2CH2CHO![]() +H2O
+H2O
试回答下列问题:
(1)A的1H-NMR谱(核磁共振氢谱)中显示吸收峰的数目为___,有机物M中含氧官能团的名称是___,C的结构简式____。
(2)D→E的转化过程中第①步反应的化学方程式为___。
(3)Ⅳ的反应类型为___,“Ⅴ”包含两步反应,其中第一步反应的试剂、条件是___。
(4)A也是合成阿斯匹林(![]() )的原料,
)的原料,![]() 有多种同分异构体,写出符合下列条件的同分异构体的结构简式___(任写一种)。
有多种同分异构体,写出符合下列条件的同分异构体的结构简式___(任写一种)。
①苯环上有3个取代基;
②仅属于酯类,能发生银镜反应,且1mol该物质反应时最多能生成4molAg;
③苯环上的一氯代物有2种。
(5)若以F和乙醛为原料来合成化合物M(![]() ),试写出合成路线____。
),试写出合成路线____。
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。)
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。该反应中被氧化的物质是__(填化学式)。
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000g样品,放入盛有20mL过量FeCl3溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50mL;
c.立即用0.2000mol·L-1Ce(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积:
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00mL.
已知:CuC1+Fe3+=Cu2++Fe2++Cl-、Fe2++Ce4+=Fe3++Ce3+
①配制100mL0.2000mol·L-1的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要___。
②进行步骤c时若操作缓慢,则测得CuCl的纯度___(“偏大”、“偏小”或“无影响")。
③通过计算确定该样品中CuCl的纯度___(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】0.10 mol镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
A. 3.2 g B. 4.0 g C. 4.2 g D. 4.6 g
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是

A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图完成一氧化氮与过氧化钠反应制备亚硝酸钠(2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3,NO能被酸性KMnO4溶液氧化为NO3-),下列说法错误的是

A.检查装置气密性后,应先打开止水夹,从导管中通入N2
B.装置C是用来吸收CO2的
C.D管中可能含有的杂质为NaNO3、NaOH
D.装置E用于处理尾气,反应中氧化剂与还原剂的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】异丁烯(![]() )是重要的化工原料,主要用于制备丁基橡胶、聚异丁烯塑料等。下列关于异丁烯的说法错误的是( )
)是重要的化工原料,主要用于制备丁基橡胶、聚异丁烯塑料等。下列关于异丁烯的说法错误的是( )
A.异丁烯发生加聚反应生成聚异丁烯
B.异丁烯在一定条件下可以和氢气发生加成反应,加成产物的二氯代物有3种
C.异丁烯与HCl在一定条件下能发生加成反应且只能得到一种加成产物
D.异丁烯和环丁烷(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
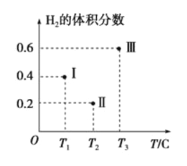
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】水蒸汽催化重整生物油是未来工业化制氢的可行方案。以乙酸为模型物进行研究,发生的主要反应如下:
Ⅰ.CH3COOH(g)+2H2O(g)2CO2(g)+4H2(g) △H1
Ⅱ.CH3COOH(g)2CO(g)+2H2(g) △H2
Ⅲ.CO2(g)+H2(g)CO(g)+H2O(g) △H3
回答下列问题:
(1)用△H1、△H2表示,△H3=___。
(2)重整反应的含碳产物产率、H2产率随温度、水与乙酸投料比(S/C)的变化关系如图(a)、(b)所示。
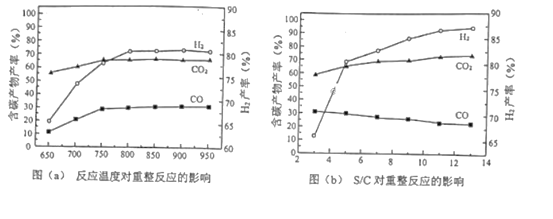
①由图(a)可知,制备H2最佳的温度约为___。
②由图(b)可知,H2产率随S/C增大而___(填“增大”或“减小”)。
(3)向恒容密闭容器中充入等物质的量的CH3COOH和H2O混合气体,若仅发生反应Ⅰ至平衡状态,测得H2的体积分数为50%,则CH3COOH的平衡转化率为___。
(4)反应体系常生成积碳。当温度一定时,随着S/C增加,积碳量逐渐减小,其原因用化学方程式表示为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是治疗某种疾病的重要成分,也可用作肥料。氨基甲酸铵是一种白色固体,易分解、易水解,难溶于CCl4。实验小组设计在实验室中用氨气和二氧化碳反应制备氨基甲酸铵。
(1)氨气的制备
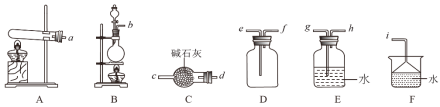
①实验室制取氨气的发生装置可以选择图中的__,反应的化学方程式为__。
②欲收集一瓶干燥的氨气,选择图中的装置,其连接顺序为:发生装置→__。(按气流方向,用小写字母表示)。
(2)氨基甲酸铵(NH2COONH4)的制备把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。制备氨基甲酸铵的装置和反应的化学方程式如下:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<0。
NH2COONH4(s) △H<0。
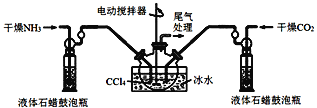
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的目的是___。
②液体石蜡鼓泡瓶的作用是__。
③从反应后的混合物中分离出产品的方法是__(填写操作名称)。
④尾气处理装置如图所示,装置中的浓硫酸的作用除了用于阻止空气中水蒸气进入反应器使氨基甲酸铵水解,还用于__。
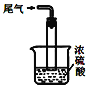
⑤取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为__。(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com