
科目: 来源: 题型:
【题目】CO2是重要的化工原理,也是应用广泛的化工产品。完成下列计算:
将2.50molCO2气体通过2.00LNaOH溶液中,CO2被完全吸收。取上述溶液20.0mL向该溶液中逐滴加入一定浓度的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
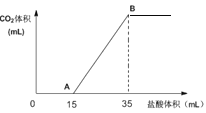
(1)当加入35mL盐酸时,产生二氧化碳的体积为_______mL(标准状况);
(2)吸收二氧化碳后,溶液中两种物质的物质的量之比为:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法中正确的是( )
①1mol Na2O 和 Na2O2 混合物中含有的阴、阳离子总数是 3NA
②常温常压下,92g的NO2和N2O4 混合气体含有的原子数为 6NA
③7.8 g![]() 中含有的碳碳双键数目为 0.3 NA
中含有的碳碳双键数目为 0.3 NA
④用 1L1.0 mol/LFeCl3 溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为 NA
⑤1mol SO2与足量O2在一定条件下充分反应生成 SO3,共转移 2NA个电子
⑥在反应 KIO3+6HI=KI+3I2+3H2O 中,每生成 3molI2 转移的电子数为 5NA
A.①②③B.②③④C.①②⑥D.④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
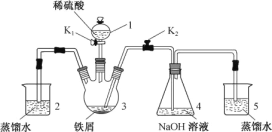
请回答:
(1) 仪器1的名称________。装置5的作用________。
(2) 实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中________。
(3) 装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的![]() ,下列说法中正确的是
,下列说法中正确的是

A.阴离子的半径从大到小排列顺序为 X>Y>Z>W
B.X、Y、Z、W 元素的氢化物分子间都可以形成氢键
C.Y 的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W>Z
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B. 100g9.8%的硫酸与磷酸的混合液中含有氧原子数为0.4NA
C. 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L
D. 0.1 mol的CaC2中含阴离子数是0.2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
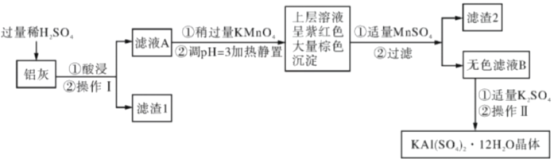
(1)明矾净水的原理是____________(用离子方程式表示)。
(2)操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥,
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):________
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_________________,滤渣2含有的物质是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R—C≡C—H![]() R—C≡C—C≡C—R+H2该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R—C≡C—C≡C—R+H2该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
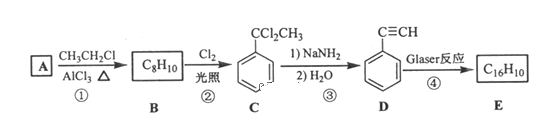
回答下列问题:
(1)B的结构简式为___,D的化学名称为___。
(2)①和③的反应类型分别为___、___。
(3)E的结构简式为___。用1molE合成1,4二苯基丁烷,理论上需要消耗氢气___mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为___。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为___。
(5)假设(4)生成1mol单一聚合度的G,若生成的G的总质量为1260g,则G的n值理论上应等于___。
(6)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式___。
(7)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化碘(IC13)在药物合成中用途非常广泛。已知ICl3熔点33℃,沸点73℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
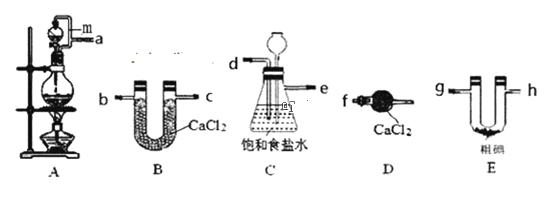
(1)按照气流方向连接接口顺序为a→___。装置A中导管m的作用是___。
(2)烧瓶中发生反应的离子方程式___,若移除酒精灯为了使反应能顺利进行烧瓶中可以放___。
(3)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞C中的现象为___。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置E适宜的加热方式为___。装置E中发生反应的化学方程式为___。
(5)该装置存在的明显缺陷是___。
(6)粗碘的制备流程为:

操作Y用到的玻璃仪器有烧杯、___,操作Z的名称为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性材料A是一种二元化合物,某研究小组按如图流程探究其组成,已知E是一种能够漂白品红的气体,亦能使酸性KMnO4溶液褪色。请回答:

(1)某同学取少量溶液C于一支试管,加入______(填化学式)试剂无现象,可证明固体B无杂质。
(2)A的化学式为:______。
(3)溶液C可溶解铜片,若反应过程中C中某离子浓度变化如图中①所示,请写出用铜离子表达的0~t1阶段的化学反应速率:v(Cu2+)=______;相对①,②可能改变的实验条件是______。

(4)已知![]() 的KI溶液中存在平衡I2+I-
的KI溶液中存在平衡I2+I-![]() I3-,该平衡常数K的表达式为:______,在
I3-,该平衡常数K的表达式为:______,在![]() 的CCl4溶液中加入KI溶液,振荡、静置后可以观察到的现象是:______。
的CCl4溶液中加入KI溶液,振荡、静置后可以观察到的现象是:______。
(5)F是一种二元酸H2M(M代表酸根)的溶液。T℃时,向某浓度的H2M溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2M、HM-、M2-的物质的量分数(![]() )与pH的关系如图所示:
)与pH的关系如图所示:

①若H2M的电离常数分别为K1与K2,则![]() ______。
______。
②按投料比n(Na2M):n(NaHM)=2:1配成溶液,下列有关该溶液的叙述正确的是______(填序号)。
A.该溶液的pH为=7.0
B.3c(Na+)+c(H+)=c(OH-)+c(HM-)+2c(M2-)
C.3c(Na+)=5[c(HM-)+c(M2-)+c(H2M)]
D.3c(OH-)+ c(M2-)=3c(H+)+2c(HM-)+5c(H2M)
(6)若F与I2的KI溶液恰好完全反应,写出反应的化学方程式______;在反应后的溶液加入足量AgNO3溶液充分反应,测得混合体系中c(I-)=amol/L,则c(SO42-)=______mol/L(已知25℃时,Ksp(AgI)=8.3×10-17,Ksp(Ag2SO4)=1.4×10-5)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com