
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1molFe溶于过量稀硝酸,电子转移数为2NA
B.标准状况下,2.24LCCl4含有分子的数目为0.1NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于丙烯(CH3—CH=CH2)的说法正确的是( )
A.丙烯分子中3个碳原子都是sp3杂化
B.丙烯分子有7个σ键,1个π键
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
查看答案和解析>>
科目: 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图 B.BF4—的结构式
B.BF4—的结构式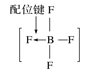
C.HF分子间的氢键 D.丙氨酸的手性异构
D.丙氨酸的手性异构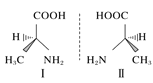
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且都位于第四周期,原子序数A<B<C。A、C核外均没有未成对电子,C位于ds区;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布图为__;D和E的电负性大小关系为__(用元素符号表示)。
(2)化合物E2D分子的空间构型为__,中心原子采用_杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_,任意写出一种它的等电子体的化学式为_。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l36.4℃。则该化合物晶体内含有的作用力类型有_。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种有机醚,可由链烃A(分子式为C4H6)通过如图路线制得,下列说法正确的是
是一种有机醚,可由链烃A(分子式为C4H6)通过如图路线制得,下列说法正确的是
A![]() B
B![]() C
C![]()
![]()
A.A的结构简式是CH2═CHCH2CH3
B.B中含有的官能团有溴原子、碳碳双键
C.C在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
D.①②③的反应类型分别为加成反应、取代反应、消去反应
查看答案和解析>>
科目: 来源: 题型:
【题目】由塑化剂引起的食品、药品问题受到广泛关注。下列关于塑化剂DBP(结构如下图)的说法不正确的是
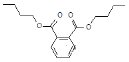
A.属于芳香族化合物,能溶于水
B.其核磁共振氢谱共有6种吸收峰
C.分子中一定有12个原子位于同一平面上
D.水解得到的酸性产物能与乙二醇发生缩聚反应
查看答案和解析>>
科目: 来源: 题型:
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中医药科技创新和人类健康事业作出巨大贡献。我国化学家在确认青蒿素分子结构之后实现了青蒿素的全合成。根据信息(部分条件和步骤已省略)回答下列问题:
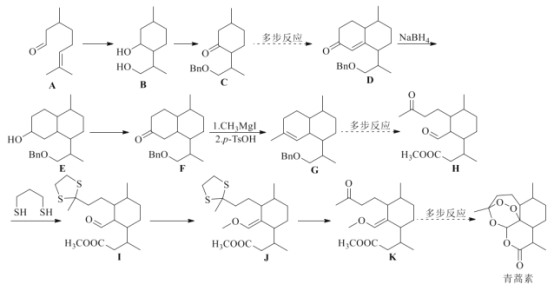
已知:![]() ,按要求回答下列问题:
,按要求回答下列问题:
(1)B的分子式为________________,所含官能团名称为________________________。![]() 的反应类型为________________。
的反应类型为________________。
(2)A的同系物中含碳原子数目最少的物质的结构简式为________________。A的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有________种,其中核磁共振氢谱峰数最少的物质的结构简式为________________。
(3)写出A与银氨溶液反应的化学方程式________________________________。
(4)通过![]() 的反应,分子中引入了硫醚基团,而
的反应,分子中引入了硫醚基团,而![]()
![]() 的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
(5)根据青蒿素所含官能团,推测其可能具有的性质________。
a.具有氧化性 b.可发生水解反应 c.易溶于水
(6)参照上述合成路线,写出以![]() 为主要原料,经四步反应制备
为主要原料,经四步反应制备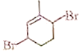 的流程。_____________
的流程。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列文献记载所涉及的化学知识叙述错误的是
A. 明代《天工开物》之《燔石·青矾》卷中“取入缸中浸三个小时,漉入釜中煎炼”,运用了过滤的化学操作。
B. “┄欲去杂还纯,再入水煎炼┄倾入盆中,经宿结成白雪”采用了重结晶的方法。
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应。
D. “水银乃至阴之毒物,因火煅丹砂而出,加以硫黄升而为银朱”该过程应用了升华的物理方法。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需______________________。
(2)酸浸时,为了提高浸取率可采取的措施有___________________________。(写出两个措施)
(3)加入H2O2的作用是_____________________________________。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是_______________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是___________________。
(6)写出上述流程中用SO2进行还原的离子方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出它们的元素符号:A________,B________,C________,D________,E________。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________(用化学式表示)
(3)画出D的离子结构示意图________。
(4)用一个方程式证明B、E的非金属性的强弱_______________。
(5)写出E的最高价氧化物的一种用途:_________。
(6)由这五种元素组成的三核10电子的分子为________,四核10电子的分子是________。由这五种元素组成的四核18电子的分子为________,五核18电子的分子是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com