
科目: 来源: 题型:
【题目】废旧钴金属片中的钴有+2价和+3价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回收钴的工艺流程如下:
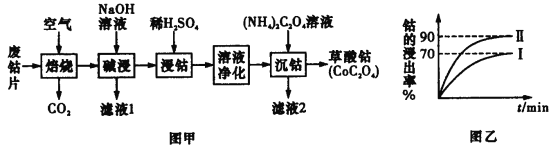
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是____________________(任写一条)。
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:____________________。
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=__________mol·L-1。
②除锰:加入NaClO溶液。写出该离子方程式:____________________。
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。

试解释为何草酸铵溶液沉钴前要减钙镁:______________________________。
(4)滤液2的主要成分为____________________(以化学式表示)。
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3),其流程如图1所示,硫酸镁和硼酸的溶解度随温度的变化曲线如图2所示。

请回答下列问题:
(1)流程中“反应”的实验装置如下图所示:
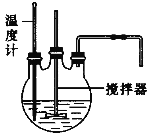
①反应时需控制在95℃进行,控制反应温度的适宜方法是____________________。
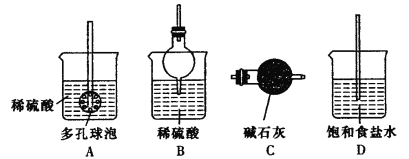
②反应产生的气体需要净化处理,请从下图中选择合适的装置__________(填字母代号)。
(2)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是______________________。
(3)实验时若被强碱溅到,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____________。
(4)滴定硼酸时不能直接滴定,因为硼酸是很弱的酸,Ka=5.7×10-10。滴定前,须先将硼酸与甘油作用生成甘油硼酸,Ka=8.4×10-6,然后用酚酞作指示剂,再用NaOH标准溶液滴定。已知硼酸的摩尔质量为61.8 g·mol-1,滴定前称取3.00 g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.200 0 mol·L-1 NaOH标准液的平均体积为20.00 mL。
①计算所得硼酸的纯度=__________。
②若用NaOH标准溶液直接滴定硼酸,则硼酸的纯度将__________(填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是
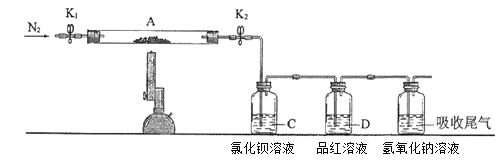
A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1mol·L-1MgSO4和0.05mol·L-1Al2(SO4)3溶液进行实验:①各取25mL,分别滴加0.5mol·L-1NaOH溶液,测得溶液pH与V(NaOH)的关系如图1;②将两种溶液等体积混合后,取出25mL,逐滴加入上述NaOH溶液,观察现象。下述正确的是 ( )
图1 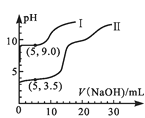 图2
图2
A.图1中的曲线II表示MgSO4与NaOH反应的关系
B.根据图1可得Ksp[Al(OH)3]的值大于1.0×10-32
C.实验②中Al(OH)3完全溶解前,溶液中c(Mg2+)/c(Al3+)逐渐变大
D.图2可以表示实验②中n(沉淀)与V(NaOH)的关系
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸,在菠菜、苋菜、甜菜等植物中含量较高。25℃时,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX [X表示 ![]() 或
或![]() 随pH的变化关系如图所示。下列说法不正确的是 ( )
随pH的变化关系如图所示。下列说法不正确的是 ( )

A.直线I中X表示的是![]()
B.直线I、Ⅱ的斜率均为1
C.0.1mol/ L NaHC2O4溶液中:c(Na+)>c(HC2O4-)> c(C2O42-)> c(H2C2O4)
D.已知:25℃时,NH3·H2O的电离常数为10-4.69,则(NH4)2C2O4溶液呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体_______g
(2)若在称量样品时,药品放在天平右盘上,磕码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为_________(同一步骤可用多次)
A、调整零点 B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量 D、称量空的小烧杯
E、将砝码放回砝码盒内 F、记录称量结果.
(4)配制Na2CO3溶液时需用的主要仪器有____________________
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、加水时越过刻度线_________ B、忘记将洗涤液加入容量瓶__________
C、容量瓶内壁附有水珠而未干燥处理______ D、溶解后没有冷却便进行定容_____
查看答案和解析>>
科目: 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,要提高反应的速率和尾气的转化率,采取的措施是( )
2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,要提高反应的速率和尾气的转化率,采取的措施是( )
A.降低温度
B.增大压强
C.在发生反应的密封容器中充入氦气
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目: 来源: 题型:
【题目】在150℃时使NH4HCO3分解,将所产生的气体依次通过Na2O2和浓H2SO4,则Na2O2增重ag,浓H2SO4增重bg;若将上述气体先通过浓H2SO4,则使酸液增重dg,再通过Na2O2,则使之增重cg。设气体皆完全被吸收,a、b、c、d质量由大到小的排列顺序正确的是
A.d a c bB.b c a dC.a c b dD.d c b a
查看答案和解析>>
科目: 来源: 题型:
【题目】将H2、O2、Cl2三种气体,按质量比为18∶128∶71混合,盛在密闭容器中用电火花引爆,充分反应后经冷却、液化,所得溶液中溶质的质量分数为( )
A.37%B.33.6%C.18.5%D.16.8%
查看答案和解析>>
科目: 来源: 题型:
【题目】向1.00L0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中( )
A.溶质为Na2CO3
B.溶质为Na2CO3、NaHCO3
C.![]() c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com