
科目: 来源: 题型:
【题目】将表面被氧化为Na2O、Na2O2的金属钠1.1g投入水中,收集到224mL气体(标准状况),该气体引爆后,冷却到原状态时,剩余气体为56mL。则Na、Na2O、Na2O2的质量分别为_____________克?
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组对NH4NO3的热分解产物提出如下4种猜想:
甲:N2、HNO3、H2O 乙:N2O、NO、H2O
丙:NH3、N2、H2O 丁:N2、NO、H2O
你认为猜想有科学性不正确的是( )
A.甲和乙B.乙和丁C.乙和丙D.丙和丁
查看答案和解析>>
科目: 来源: 题型:
【题目】在100mL0.5mol/L的NaOH溶液中通入一定量的CO2,测得反应后的溶液中CO32-和HCO3-的物质的量浓度之比为1∶3,则通入的CO2气体在标准状况下的体积是________________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案或实验结论不正确的是( )

A.图Ⅰ结论,元素非金属性:C>Si
B.图Ⅱ结论,氧化性:Cl2>Fe3+
C.图Ⅲ结论,溶液pH:Na2CO3>NaHCO3
D.图Ⅳ结论,酸性:H2SO4>H2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g) △H>0,达到平衡状态,进行如下操作:
2CO(g) △H>0,达到平衡状态,进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④B.①③C.①②D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物G可用来制备抗凝血药,可通过下列路线合成。
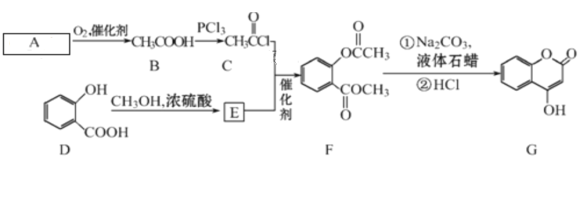
请回答:
(1)A 的结构简式________,在A→B的反应中,检验A是否反应完全的试剂为_________。
(2)C+E→F的反应类型是____,F中含有的官能团名称为________。
(3)写出G和过量NaOH溶液共热时反应的化学方程式____________。
(4)化合物E的同分异构体很多,符合下列条件的结构共有___种,①含苯环;②苯环上有两个取代基;③能与醇发生酯化反应;④不含-OCO-结构。所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(5)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)_____。
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸盐(如ZnS2O4)在工业中用作漂白剂、解毒剂、吸氧剂等,用途十分广泛。
Ⅰ.制取ZnS2O4溶液和晶体
控制3545℃进行反应,原理为:Zn+2SO2=ZnS2O4。
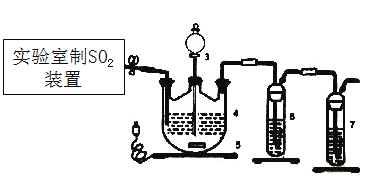
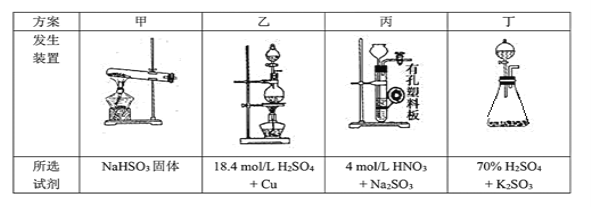
(1)下列四种制备SO2的方案中最佳选择是___________。
(2)停止电加热,仪器3放入一定量乙醇,制得ZnS2O4晶体,主要原因是_________。
Ⅱ.测定产率
(3)仪器4中加入mg锌粉与一定量的水,电加热并启动磁力搅拌器5。一段时间后,待固体物质完全消失时,关闭活塞和止水夹。取ZnS2O4晶体的十分之一放于真空容器中,加适量的水、通适量氧气使其恰好转化为Zn(HSO4)2和Zn(HSO3)2固体,然后加入足量的硫酸,通过测定生成气体的体积来求算ZnS2O4晶体的产率。请回答下列相关问题:
①测定装置中,导管A的作用:一是________;二是________。
②为提高测定的准确度,仪器B中最宜选用_____________。
A.饱和食盐水 B.饱和NaHSO3溶液 C. 饱和澄清石灰水 D.98.3%的浓硫酸
③用图中量气管读数为起点,若终点读数为17.60mL,且实验温度下气体摩尔体积为VmL.mol-1,可得出ZnS2O4的产率为 ____________%。
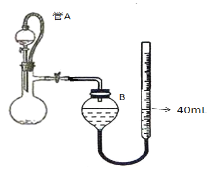
(4)如果反应温度超过45℃,会导致ZnS2O4分解,仪器4中有黄色沉淀、白色沉淀且伴随着气泡生成,则ZnS2O4分解的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里用二氧化锰与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,计算:
(1)理论上需要参加反应的二氧化锰_______克?
(2)浓盐酸的物质的量浓度为_____________?
(3)被氧化的HCl的质量为______________克?
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
①△H3=____kJ/mol。
②在恒定压强、T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中发生I、Ⅲ反应,5 min后反应达到平衡状态,此时CH3OH(g) 物质的量为2mol,CH3OCH3(g)的物质的量为0.5mol;则T1温度时反应I的平衡常数Kc的计算式为______。
③恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图 。其中:CH3OH的选择性=![]() ×100%
×100%

在上述条件下合成甲醇的工业条件是_____________。
A.210℃ B. 230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
(2)一定条件下,可以通过CO与SO2反应生成S和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的化学方程式___________。在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图所示:
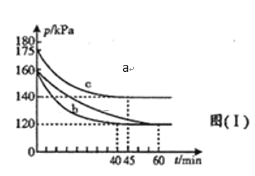
①图中三组实验从反应开始至达到平衡时,反应速率v(CO)最大的为_____(填序号)。
②与实验a相比,c组改变的实验条件可能是___________。
(3)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点时溶液pH=7,则n(NH4+):n(HSO3)=________。

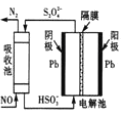
(4)间接电化学法可除NO。其原理如图所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com