
科目: 来源: 题型:
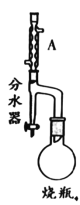
【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
 +CH3OH
+CH3OH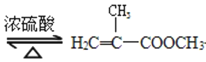 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素A、B、C、D、E原子序数依次增大;A与B可形成4核10电子的分子;C、E同主族,D、E同周期;C和D可形成离子化合物D2C,D2C中阴阳离子的电子层结构相同,且电子总数为30。
请回答下列问题![]() 用元素符号表示
用元素符号表示![]() :
:
(1)元素A的一种同位素质子数与中子数相等,这种同位素的符号是______。
(2)元素B在周期表中的位置是______。
(3)元素A与B形成10电子的分子,其水溶液呈碱性,用电离方程式表示______。
(4)元素A、B、C形成的原子个数比为4:2:3的盐,属于______![]() 填“离子“或“共价“
填“离子“或“共价“![]() 化合物,含有的化学键类型为______。
化合物,含有的化学键类型为______。
(5)元素C、D形成化合物D2C2的电子式为______,其与水反应的离子方程式为______。
(6)元素C、D、E、F形成简单离子的半径由小到大的顺序为______。
(7)元素E与F相比,元素原子得电子能力较强的是______,用离子方程式证明______。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、Q、R是原子序数依次增大的短周期主族元素。已知:气体YX3能使润湿的紫色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍。回答下列问题:
(1)![]() 原子的结构示意图为 _____,YX3的化学式为 _____。
原子的结构示意图为 _____,YX3的化学式为 _____。
(2)![]() 、Q、R原子的半径从大到小的顺序是 ___________。
、Q、R原子的半径从大到小的顺序是 ___________。![]() 用原子符号表示
用原子符号表示![]() 。
。
(3)![]() 分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
(4)能证明R的非金属性比Q强的实验事实是______![]() 填字母序号
填字母序号![]() 。
。
A HR的水溶液酸性比H2Q的水溶液酸性强 B R2与H2化合比Q与H2化合容易。
C R的最高价氧化物的水化物的酸性比Q的强 D HR的稳定性比H2Q强
查看答案和解析>>
科目: 来源: 题型:
【题目】分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有( )(不考虑立体异构)
A.8种B.10种C.13种D.16种
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
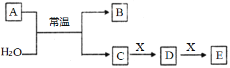
(1)若A为常见的金属单质,且其焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为__(填字母)。
a.NaHCO3 b.Na2CO3 c.Al(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为___。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___。(填字母)
a.盐酸 b.CaCl2溶液 c.氨水 d.澄清石灰水
(二)工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度均为0.1mol![]() L-1。
L-1。
阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
某同学欲探究该废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ 中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有___,阴离子是有___。(写离子符号)
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为___。
(3)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为__g。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是有机物R 的结构简式,它可用于生产 S﹣诱抗素,下列关于R 的说法正确的是
( )

A.R 结构中含手性碳原子数多于 1 个
B.R 可以在酸性条件下充分水解生成两种有机产物
C.R 可以发生氧化、取代、加聚、缩聚反应,并能与盐酸反应生成有机盐
D.1 mol R 分别与足量NaOH 溶液、足量溴水反应,最多消耗 4 mol NaOH 和 5 mol Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】标号为①-⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)②号元素是______![]() 填元素符号
填元素符号![]() ,⑨号元素的离子结构示意图为______
,⑨号元素的离子结构示意图为______
![]() 任写两种
任写两种![]() 。
。
(3)用电子式表示①④号元素形成的最简单化合物的形成过程______
(4)③的最高价氧化物与⑧的单质在点燃条件下发生反应的化学方程式______
(5)①、⑤、⑦号元素形成的化合物的电子式是______,该化合物所含化学键的类型为______
查看答案和解析>>
科目: 来源: 题型:
【题目】十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
Ⅰ C10H18(l)==C10H12(l)+3H2(g) ΔH1 Ⅱ C10H12(l)==C10H8(l)+2H2(g) ΔH2
假设某温度下, ΔH1>ΔH2>0。在下图中绘制下列“C10H18→C10H12→C10H8”的“能量~反应过程” 示意图正确的是: ( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)①-中,属于长周期的元素是______![]() 填序号
填序号![]() 。
。
(2)①-![]() 填元素符号
填元素符号![]() ,在空气中燃烧的产物是______
,在空气中燃烧的产物是______![]() 写出电子式
写出电子式![]() 。
。
(3)①-中中,最不活泼的元素其原子结构示意图为______。
(4)③④⑤三种元素对应的简单阳离子中,半径最大的离子结构示意图为______。
(5)在这些元素的最高价氧化物对应水化物中,呈两性的氢氧化物是______![]() 写化学式
写化学式![]() 。
。
(6)若将④⑤的单质用导线相连插入稀硫酸溶液中形成原电池,则该原电池的负极反应式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Y 是一种天然除草剂,其结构如图所示,下列说法正确的是( )
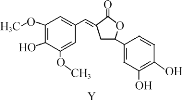
A.Y 可以和NaHCO3 溶液发生反应
B.Y 分子中所有碳原子一定在同一平面内
C.1 mol Y 最多能与 6 mol NaOH 反应
D.Y 与足量的H2加成反应的产物含 7 个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com