
科目: 来源: 题型:
【题目】将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是( )
A.NaOH、NaCl、NaAlO2B.KNO3、NaCl、CH3COONa
C.Na2S、(NH4)2SO3、AgNO3D.KNO3、Na2SO3、NH4HCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
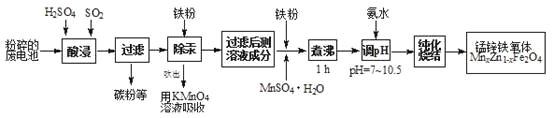
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。

①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验设计正确的是( )
操作 | 现象 | 结论 | |
A | 将SO2通入溴水 | 溴水褪色 | SO2具有漂白性 |
B | 将乙烯通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 乙烯具有还原性 |
C | 将澄清石灰水滴入某溶液 | 出现白色浑浊 | 其溶液中存在CO32- |
D | 将硝酸银溶液滴入某溶液 | 出现白色沉淀 | 其溶液中存在Cl- |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。
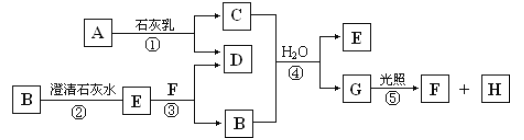
请回答以下问题:
(1)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为____。
(2)A中元素的原子结构示意图为____。
(3)F在溶液中的电离方程式为_____。
(4)上述反应中属于氧化还原反应的是___(填写序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醛能够发生下列反应:
Cu2O+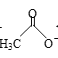
![]()
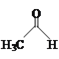
![]()

![]()

(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为___。
(3)CH3CHO分子中氧原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
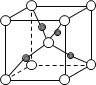
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在等体积①pH=1的硫酸;②0.01mol·L-1NaOH溶液;③pH =10的纯碱溶液中;水电离程度的大小顺序是( )
A.①>②>③B.②>①>③C.③>①>②D.③>②>①
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
(1)写出步骤①的化学方程式:___。
(2)步骤②经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的主要化学操作的名称是___;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___。
(3)请写出二氧化硅与氢氟酸反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜
、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜![]() 含杂质
含杂质![]() 为原料,一种制备铜的氯化物的流程如下:
为原料,一种制备铜的氯化物的流程如下:
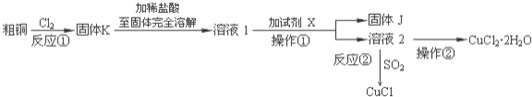
(1)上述流程中固体K溶于稀盐酸的目的是 ______ ![]() 试剂X、固体J的物质分别为 ______ .
试剂X、固体J的物质分别为 ______ .
A.NaOH![]() B.CuO
B.CuO![]() C.
C.![]()
![]()
![]()
![]()
(2)反应②是向溶液2中通入一定量的![]() ,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
(3)以石墨为电极,电解![]() 溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列各小题。
Ⅰ.按要求书写下列化学方程式
(1)2-甲基-1,3-丁二烯与等物质的量的溴发生1,4-加成的反应:_______。
(2)乙醛与新制氢氧化铜悬浊液加热反应:______。
(3)CH3CHClCOOCH2CH3与氢氧化钠水溶液共热:____。
(4)乙二醇和乙二酸脱水成环酯:_____。
Ⅱ.有一种有机物X的键线式如图所示。

(5)X的分子式为________。
(6)有机物Y是X的同分异构体,且属于芳香族化合物,则Y的结构简式是____。
(7)Y在一定条件下可生成高分子化合物,该反应的化学方程式是___。
(8)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有____种。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G、H、I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:
(1)B单质分子中![]() 与
与![]() 键数目比为____。B、C、D第一电离能由小到大的顺序为________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色的络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为______(写一种即可),该分子中心原子轨道的杂化类型为_______,该阴离子空间构型为_______。
(3)D与G可以形成如图的晶胞,则黑点表示的是元素_______(填写元素符号),该元素原子在该晶胞中的配位数为______。
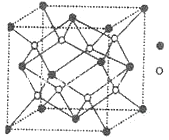
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com