
科目: 来源: 题型:
【题目】下列关于同分异构体的说法正确的是 ( )
A.分子式为C3H6BrC1的有机物不考虑立体异构共4种
B.C8H11N的同分异构体中含苯环且苯环上有两个取代基的种数为9
C.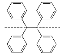 的一氯代物有5种
的一氯代物有5种
D.![]() 的一氯代物有4种
的一氯代物有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)

查看答案和解析>>
科目: 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值) ( )
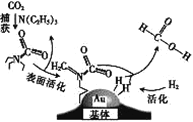
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1g N(C2H5)3中所含的非极性共价键数目为1.8NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs 太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价电子排布图为_________;高温下CuO 容易转化为Cu2O,试从原子结构角度解释原因:_____。
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为_____(用元素符号表示)
(3)GaCl3和AsF3的立体构型分别是_____,_____。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为_____。②[B(OH)4 ]-的结构式为_____。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
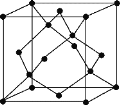
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_____(用化学式表示);②金刚石的晶胞参数为a pm(1pm=10-12 m)。1cm3晶体的平均质量为_____g(只要求列算式,阿伏加德罗常数为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构如下图所示,关于该物质的下列说法不正确的是
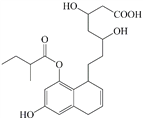
A. 遇FeCl3溶液发生显色反应
B. 能发生取代、消去、加成反应
C. 1 mol该物质最多能与4mol Br2反应
D. 1 mol 该物质最多能与4 mol NaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】关于CO2和CO32-的下列说法正确的是 ( )
A.两种微粒的中心原子均无孤电子对B.两种微粒价层电子对数相同
C.键角:CO32-> CO2D.两种微粒的中心原子杂化方式相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B.无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
C.制玻璃和水泥都要用到石灰石原料
D.1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为NaCl晶体的一个晶胞,测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g·cm-3,则阿伏加德罗常数可表示为多少________________________(书写计算的步骤)。

查看答案和解析>>
科目: 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O35H2O反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)

实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)仪器a的名称是_________,其作用是__________________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________。检验是否存在该杂质的方法是________________________________。
(3)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 molL-1碘的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-。
(4)滴定至终点时的判断依据是___________________________。
(5)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_______mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M)_________。(用含M的式子表达)

查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)与O2(g)反应生成NO(g)过程中的能量变化:
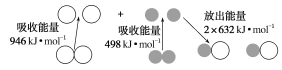
下列说法中正确的是( )
A.1 mol N2(g)与1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)与O2(g)混合能直接生成NO(g)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com