
科目: 来源: 题型:
【题目】咖啡酸苯乙酯有极强的抗炎和抗氧化活性而起到抗肿瘤的作用.现设计出如下路线合成缓释药物聚咖啡酸苯乙酯:

已知:B的核磁共振氢谱有三个波峰;红外光谱显示咖啡酸分子中存在碳碳双键;且:
![]() ;
;![]()
![]() 咖啡酸仅含C、H、O三种元素,蒸气密度是相同条件下
咖啡酸仅含C、H、O三种元素,蒸气密度是相同条件下![]() 的90倍,含氧质量分数为
的90倍,含氧质量分数为![]() ,则咖啡酸的分子式为 ______ ;咖啡酸可与
,则咖啡酸的分子式为 ______ ;咖啡酸可与![]() 溶液反应生成气体,1mol咖啡酸与足量钠反应生成
溶液反应生成气体,1mol咖啡酸与足量钠反应生成![]()
![]() ,咖啡酸中所有含氧官能团的名称: _____;
,咖啡酸中所有含氧官能团的名称: _____;
![]() 写出下列反应的类型:
写出下列反应的类型:![]() ______ ,
______ ,![]() ______ .
______ .
![]() 写出反应
写出反应![]() 的化学方程式: ______ .
的化学方程式: ______ .
![]() 写出反应
写出反应![]() 的化学方程式: ______ .
的化学方程式: ______ .
![]() 满足下列条件的咖啡酸的同分异构体有 ______ 种.任写三种 ______ .
满足下列条件的咖啡酸的同分异构体有 ______ 种.任写三种 ______ .
![]() 含有两个羧基
含有两个羧基![]() 苯环上有三个取代基.
苯环上有三个取代基.
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是

A.燃料电池工作时,负极反应为HCHO+H2O-4e-=CO2+4H+
B.当燃料电池消耗2.24L甲醛气体时,电路中理论上转移0.2mole-
C.当a、b都是铜电极时,电解的总反应方程式为:2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
D.电解后,消耗的甲醛和a电极上析出物质的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题。
(1)CS2是一种常用的溶剂,CS2的分子中存在________个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是______,键长较长的是_____。
(2)氢的氧化物与碳的氧化物中,分子极性较小的是________(填分子式)。
(3)醋酸的球棍模型如图1所示。
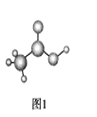
①在醋酸中,碳原子的轨道杂化类型有________;
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是________(填选项字母)。
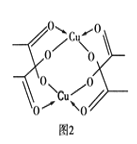
A.极性键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目: 来源: 题型:
【题目】已知pAg+=lgc(Ag+),pX=lgc(X)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. a和c两点的Kw相同
B. Ksp(AgCl)=1.0×1014 mol2·L2
C. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
D. AgCl(s)+Br(aq)![]() AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
AgBr (s)+Cl(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1 mol A、2 mol B,此时甲、乙的容积均为2 L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:A(g)+2B(g)![]() 2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是

A. 甲中反应的平衡常数小于乙
B. 若打开活塞K,达平衡时乙容器的体积为3.2 L
C. 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态
D. 平衡时甲容器中A的物质的量小于0.55 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
(1)基态铜原子的电子排布式为_______________;已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是_________________________。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为____________,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si(填“>”、“<”)。
(3)SeO2常温下白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体的晶体类型为_________;若SeO2类似于SO2是V型分子,则Se原子外层轨道的杂化类型为_________。
(4)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______,B与N之间形成_________键。
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为________,在SiC中,每个C原子周围最近的C原子数目为___个;若晶胞的边长为a pm,则金刚砂的密度表达式为_________g/cm3。
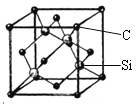
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将pH和体积均相同的HNO2和CH3COOH溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是

A.电离平衡常数:Ka(CH3COOH)>Ka(HNO2)
B.从c点到d点,溶液中 的值保持不变
的值保持不变
C.溶液中水的电离程度:b>c
D.a点时,相同体积的两溶液分别与NaOH恰好中和后,溶液中的n(Na+)相等
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示图象中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按试题将相应图的字母填入下列空格中,并写出所发生反应的离子方程式.

(1)表示向饱和AlCl3溶液中滴加氨水至过量的是 ______ ,离子方程式:_____ 。
(2)表示向饱和AlCl3溶液中滴加NaOH至过量的是 ______,NaOH过量时的离子方程式:_____。
(3)表示向饱和石灰水中通入CO2至过量的是 _____,CO2少量时的化学方程式:_____。
(4)表示向MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量的是 ______,Mg2+生成沉淀的离子方程式: ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
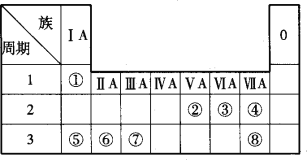
(1)在元素①~⑧中,非金属性最强的元素是____________(填元素名称)。
(2)在元素①~⑧中,原子半径最大的是___________(填元素名称)。
(3)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的顺序排列是____________(用化学式表示)。
(4)用电子式表示元素①和⑧组成的化合物的形成过程____________。
(5)为验证ⅦA族部分元素非金属性的递变规律,设计了如图所示装置进行实验,请回答:
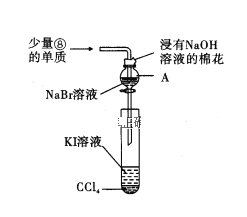
①仪器A的名称是_____, A中发生反应的离子方程式是_______。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)___________。
③为验证溴与碘非金属性强弱:通入少量⑧的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到____。
④ⅦA族元素非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,______,得电子能力逐渐减弱。
查看答案和解析>>
科目: 来源: 题型:
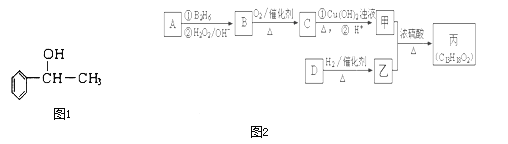
【题目】苏合香醇可以用作食用香精,其结构简式如图1所示.
已知:R-CH=CH2 ![]() R-CH2CH2OH
R-CH2CH2OH
![]() 一
一![]() 苏合香醇的分子式为 ______ ,它不能发生的有机反应类型有
苏合香醇的分子式为 ______ ,它不能发生的有机反应类型有![]() 填数字序号
填数字序号![]() ______ .
______ .
![]() 取代反应
取代反应![]() 加成反应
加成反应![]() 消去反应
消去反应![]() 加聚反应
加聚反应![]() 氧化反应
氧化反应![]() 水解反应,
水解反应,
![]() 二
二![]() 有机物丙是一种香料,其合成路线如图
有机物丙是一种香料,其合成路线如图![]() 其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰;乙与苏合香醇互为同系物.
其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰;乙与苏合香醇互为同系物.
![]() 按照系统命名法,A的名称是 ______ .
按照系统命名法,A的名称是 ______ .
![]() 与新制
与新制![]() 悬浊液反应的化学方程式为 ______ .
悬浊液反应的化学方程式为 ______ .
![]() 丙中含有两个
丙中含有两个![]() ,D可发生银镜反应,在催化剂存在下1molD与2mol
,D可发生银镜反应,在催化剂存在下1molD与2mol![]() 可以反应生成乙,则D的结构简式为 ______ .
可以反应生成乙,则D的结构简式为 ______ .
![]() 甲与乙反应的化学方程式为 ______ .
甲与乙反应的化学方程式为 ______ .
![]() 苯环上有3个取代基或官能团,且显弱酸性的乙的同分异构体共有 _____ 种,其中3个取代基或官能团互不相邻的有机物结构简式为 ______ .
苯环上有3个取代基或官能团,且显弱酸性的乙的同分异构体共有 _____ 种,其中3个取代基或官能团互不相邻的有机物结构简式为 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com