
科目: 来源: 题型:
【题目】过氧化钙可用于治理赤潮、应急供氧等。已知:过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢。某小组同学探究过氧化钙的制法和性质:
(1)甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是______(填A、B)
方法A Ca (OH)2 (s) + H2O2 CaO2 (s) + 2H2O
方法B CaCl2 (s) + H2O2 CaO2 (s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是 ___________(填化学式)
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是______________。
(2)丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:
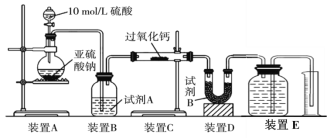
①试剂B的作用是____________________。
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:______________________________。
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =______。
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:
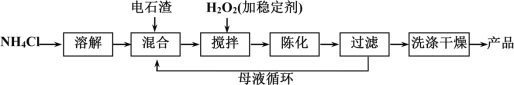
用上述方法制备过氧化钙(CaO2·8H2O),搅拌步骤的化学方程式是______________。
②某小组釆用单变量法确定温度、H2O2浓度对产率的影响,结果如下,则实际生产应选择的适宜条件为__________。
H2O2 % | 30% | 25% | 20% | 15% | 10% | 5% | ||||||
产率 | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 | ||||||
温度(℃) | 50 | 40 | 30 | 20 | 10 | 0 | ||||||
产率 | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 | ||||||
查看答案和解析>>
科目: 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。

查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法错误的是 ( )
A.In是第五周期第ⅢB族元素B.![]() In的中子数与电子数的差值为17
In的中子数与电子数的差值为17
C.原子半径:In>AlD.碱性:In(OH)3<RbOH
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);
(2)100 ℃时,体系中各物质浓度随时间变化如图所示。
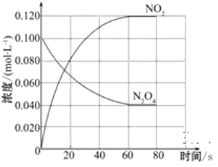
在0~60 s时段,反应速率v(N2O4)为___________________mol·L-1·s-1;反应的平衡常数K的数值为_________________________(保留两位小数)。
(3)100 ℃时,反应达平衡后,将反应容器的容积减少一半。平衡向________(填“正反应”或“逆反应”)方向移动。
(4)100 ℃时达平衡后,改变反应温度为T,c(N2O4) 以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T________100 ℃(填“大于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】⑴可逆反应FeO(s)+CO(g)Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1100 |
K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量________;充入氦气,混合气体的密度________(填“增大”“减小”或“不变”)。
⑵常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________ (填编号)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②据上表数据,请你判断下列反应不能成立的是________(填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN C.CO2+H2O+2NaClO=Na2CO3+2HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是
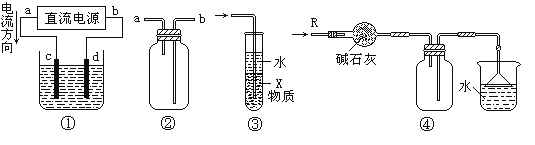
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图。根据题意回答问题:

已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑
8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
③Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(2)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。酸化步骤用醋酸调节溶液pH<5,其目的是________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、_______、过滤、_______、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1___ΔH2(填“>”“<”或“=”,下同)。
(2)相同条件下,1 molP4所具有的能量___4 molP原子所具有的能量。
(3)已知P4(白磷,s)4P(红磷,s) ΔH=-17kJ·mol-1,比较下列反应中ΔH的大小:ΔH1___ΔH2。
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(4)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,则浓硫酸和稀氢氧化钠溶液反应生成2mol水,放出的热量___114.6kJ。
(5)已知:28gFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了akJ热量,该反应的热化学方程式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com