
科目: 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
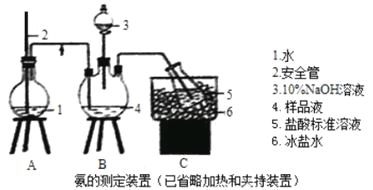
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
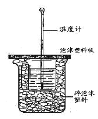
(1)图中未画出的实验器材是______________。
(2)烧杯间填满碎纸条的作用是 ___________________________。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
①试计算上述实验测出的中和热ΔH1=______________。
②如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)
③如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将____(填“偏大”、“偏小”、“不变”) , 其理由是___
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-的电子式可表示为_____;1mol C22-中含有的![]() 键数目为________。
键数目为________。
(2)将乙炔通入[Cu(NH3)2Cl]溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为___。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是________;分子中处于同一直线上的原子数目最多为___________。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_________。

查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示:
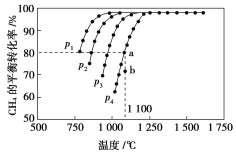
则:(1)该反应的ΔH________0(填“<”“=”或“>”)。
(2)压强p1、p2、p3、p4由大到小的顺序为______________。压强为p4时,在b点:v(正)________v(逆)(填“<”“=”或“>”)。
(3)对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=________;如果p4=0.36 MPa,求a点的平衡常数Kp=________ (保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO)。
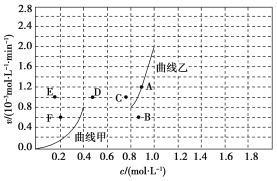
则:①与曲线v正~c(CH4)相对应的是上图中曲线______(填“甲”或“乙”)。
②当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为________(填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是
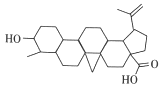
选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请根据该装置回答下列问题:
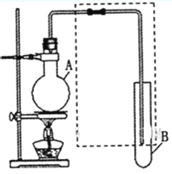
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A中加入的试剂在混合时的操作方法是___________,反应的化学方程式为___________,试管B中应加入___________。虚线框中的导管除用于导气外,还兼有___________作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇与乙酸外,还应先加入适量的试剂___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
(3)若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________,试管B中应加入___________。
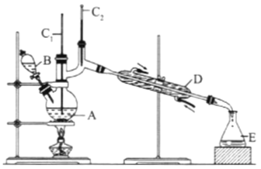
(II)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛,发生:CH3CH2CH2CH2OH→![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。
反应物和产物的相关数据列表:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由:__________。
(2)加入沸石的作用是__________;若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,B仪器的名称是__________,D仪器的名称是__________。
(4)分液漏斗使用前必须进行的操作是(填字母)__________。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在__________层(填“上”,或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________。
(7)本实验中,正丁醛的产率为__________%。.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作以及实验现象完全一致的是( )
A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
B | 向饱和碳酸钠溶液中通入过量 | 有白色固体析出 |
C | 将新制的氯水滴到蓝色石蕊试纸上 | 试纸变红 |
D | 将用砂纸打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落下来 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:
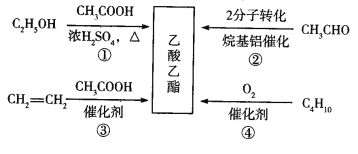
下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
科目: 来源: 题型:
【题目】用石墨电极电解100mL的氯化钠溶液,当电路中通过1mole-时,阴阳两极产生的气体体积比为5:3,则原氯化钠溶液的物质的量浓度(mol/L)为( )
A.4B.2C.1D.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com