
科目: 来源: 题型:
【题目】SO2的催化氧化是工业制取硫酸的关键步骤之一:2SO2 + O2![]() 2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2molSO2和1molO2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2molSO2和1molO2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
容器温度 物质的量(mol) | a容器 400℃ | b容器 425℃ | c容器 450℃ | d容器 475℃ | e容器 500℃ |
O2 | x | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | y | 0.8 | 1.4 | 1.0 | 0.6 |
(1)5min时测得a容器中混合气体的物质的量减少了0.2mol,计算5min内SO3的平均反应速率____________。
(2)反应进行到5min时,b容器中的反应是否达到平衡状态?_______(填“是”或“否”),理由是:_____________________________________________________________________________。
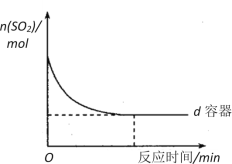
(3)在图中画出e容器中SO2物质的量随时间的变化曲线_______________________。
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:___________________。
(5)已知NaHSO3溶液呈酸性,溶液中c(H2SO3)_______ c(SO32—)(选填<、>或=);NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】衣康酸M是制备高效除臭剂、粘合剂等多种精细化学品的重要原料,可经下列反应路线得到(部分反应条件已略)。
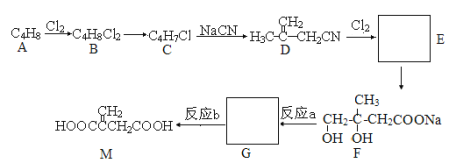
已知:①R-CH2-Cl + NaCN → R-CH2-CN + NaCl
②R-CH2-CN + NaOH + H2O → R-CH2-COONa + NH3
完成下列填空:
(1)A的结构简式是_____________,M中官能团的名称是________________,
(2)写出B→ C的化学反应方程式________________________________________。写出G的结构简式______________________________________
(3)反应a与反应b的先后顺序不能颠倒,解释原因:_________________________________________________________________________。
(4)写出由A和1,3—丁二烯1:1共聚所得高聚物的结构简式____________________________
(5)请设计由CH2=CHCH2OH 制备CH2=CHCOOH的合成路线(无机试剂任选)________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如下图所示的实验装置(固定装置已略去)。
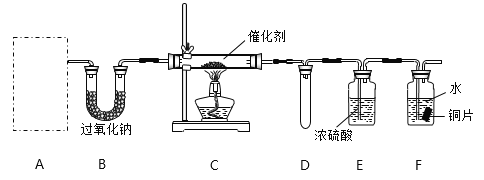
①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_______(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是___________________;装置D的作用是___________________。
③装置C中发生反应的化学方程式为________________________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_____________________________。
⑤该装置存在的主要缺陷是___________________________________________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。
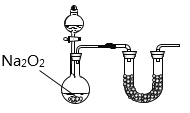
①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是___________,U型管中加入的试剂是___________。
②此装置能产生大量氨气的原因是___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,反应2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积
2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积![]() (SO3)随温度变化的曲线应为 ( )
(SO3)随温度变化的曲线应为 ( )
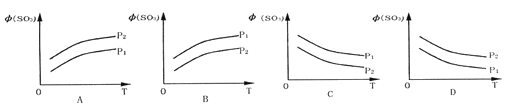
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是重要的化工原料。
(1)检验氨气极易溶于水的简单操作是:收集一试管氨气,______________。
(2)往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为_________;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入________,请说明这样操作为什么可以析出较多NH4Cl的原因:_________________。某NaHCO3晶体中含有NaCl杂质,某同学在测定其中NaHCO3的含量时,称取5.000g试样,定容成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol/L盐酸溶液的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如图Ⅰ | 如图Ⅱ |
(3)定容过程中需要用到的仪器有烧杯、玻璃棒、___________和____________。
(4)当滴定至__________________________,即为滴定终点;第二次滴定,从图I图II显示消耗的盐酸溶液体积为_________mL。

(5)该实验测定样品中NaHCO3的质量分数为__________(保留2位小数)。
(6)若该同学测定结果偏大,请写出一个造成该误差的原因_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2S常用作皮革脱毛剂,工业上用反应Na2SO4 +2C ![]() Na2S+2CO2↑ 进行制取。
Na2S+2CO2↑ 进行制取。
(1)上述反应中涉及的各元素中原子半径最小的是_______(填元素符号),该原子有_____种不同能量的电子。
(2)羰基硫的化学式为COS,结构和CO2 相似,请写出COS的电子式_________,判断羰基硫分子属于________(选填“极性”或“非极性”)分子。
(3)写出一个能比较S和O非金属性强弱的化学事实_____________________ ;请从原子结构解释原因_____________________________。
(4)将Na2S溶液滴入AlCl3溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解释上述现象__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如下图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的 乙炔气体中往往含有少量的 H2S 和PH3气体,请按下列要求填空:
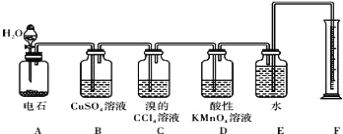
(1)实验室制乙炔的化学方程式是:_________________;为了得到较为平稳的乙炔气流, 装置 A 的分液漏斗中常用______________来代替水.
(2) 装置 D 中观察到的现象是 ___________________________________________
(3) 装置 B 中CuSO4溶液的作用是_______________________________.
(4)写出以乙炔和HCl为原料,合成聚氯乙烯的方程式是________________,___________________ 。
(5)若称取m g 电石,反应完全后,生成的乙炔n g,则CaC2的纯度为_____(用m与n表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】M是聚合物胶黏剂、涂料等的单体,其一条合成路线如下(部分试剂及反应条件省略):

完成下列填空:
(1)反应①的反应类型是____________。反应④的反应条件是_____________。
(2)除催化氧化法外,由A得到![]() 所需试剂为___________。
所需试剂为___________。
(3)已知B能发生银镜反应。由反应②、反应③说明:在该条件下,_______________。
(4)写出结构简式。C________________ M________________
(5)D与1-丁醇反应的产物与氯乙烯共聚可提高聚合物性能,写出该共聚物的结构简式。_____________
(6)写出一种满足下列条件的丁醛的同分异构体的结构简式。____________
①不含羰基②含有3种不同化学环境的氢原子
已知:双键碳上连有羟基的结构不稳定。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年4月23日,中国人民海军成立69周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。镍铬钢抗腐蚀性能强,可用于建造航母。
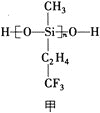
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷(结构如图甲所示)。基态Cr原子的价电子排布式为_____________,基态Si原子电子占据最高能级的电子云轮廓图为_____________形,元素C、O、F的电负性由大到小的顺序为_____________。
(2)海洋是元素的摇篮,海水中含有大量F、Cl、Br、I元素。
①OF2的空间构型为_____________,其中O原子杂化方式为_____________杂化。
②KCl晶体中存在的化学键类型有_____________;CaCl2熔点要比KCl的熔点高很多,主要原因为____________________________________________________________________。
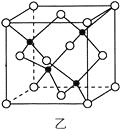
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶胞结构如图乙所示(黑球表示Zn2+,白球表示S2-),Zn2+的配位数为_____________。晶胞边长为a nm、ZnS相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M是一种常用香料的主要成分之一,其合成路线如下。
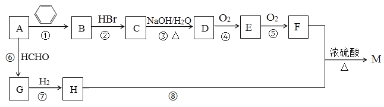
已知:
①相同条件下1体积烃A完全燃烧消耗4体积氧气;
②RC≡CH+HCHO![]() RC≡CCH2OH;
RC≡CCH2OH;
③反应①的原子利用率为100%,反应类型属于加成反应;
④M的分子式为C13H18O2。
回答下列问题:
(1)A的名称为___________;G分子中有___ _个碳原子在同一条直线上。
(2)反应②~⑧中属于加成反应的是______;H中官能团的名称为___________。
(3)物质M的结构简式为____________。B的一种同类别异构体存在顺反异构,该物质发生加聚反应生成的高分子化合物的结构简式为_____________。
(4)反应③的化学反应方程式为_______________。
(5)符合下列条件的F的同分异构体共有_____种。
①能发生银镜反应;②能发生水解反应;③属于芳香族化合物。
其中核磁共振氢谱为4组峰,且峰面积之比为6∶2∶1∶1的为 (任写一种物质的结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com